Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Đặt \(\hept{\begin{cases}n_{Al}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{cases}}\)
PTHH : \(2Al+3H_2SO_4-->Al_2\left(SO_4\right)_3+3H_2\) (1)
\(Al+6HNO_3-->Al\left(NO_3\right)_3+3NO_2+3H_2O\) (2)
\(Cu+4HNO_3-->Cu\left(NO_3\right)_2+2NO_2+2H_2O\) (3)
Theo pthh (1) : \(n_{Al}=\frac{2}{3}n_{H_2}=0,2\left(mol\right)\) => \(x=0,2\left(mol\right)\)
Theo ptr (2); (3) : \(n_{NO_2}=3n_{Al}+2n_{Cu}\)
=> \(0,8=0,2\cdot3+2\cdot n_{Cu}\)
=> \(n_{Cu}=0,1\left(mol\right)\)
=> \(a=0,2\cdot27+0,1\cdot64=11,8\left(g\right)\)
b) PTHH : \(NH_3+HNO_3-->NH_4NO_3\) (4)
\(3NH_3+3H_2O+Al\left(NO_3\right)_3-->Al\left(OH\right)_3\downarrow+3NH_4NO_3\) (5)
\(2NH_3+2H_2O+Cu\left(NO_3\right)_2-->Cu\left(OH\right)_2\downarrow+2NH_4NO_3\) (6)
BT Al : \(n_{Al\left(OH\right)_3}=n_{Al}=0,2\left(mol\right)\)
BT Cu : \(n_{Cu\left(OH\right)_2}=n_{Cu}=0,1\left(mol\right)\)
=> \(m\downarrow=m_{Al\left(OH\right)_3}+m_{Cu\left(OH\right)_2}=25,4\left(g\right)\)
c) Gọi tên KL là X .
PTHH : \(2Al\left(NO_3\right)_3-t^o->Al_2O_3+6NO_2+\frac{3}{2}O_2\) (7)
\(Cu\left(NO_3\right)_2-t^o->CuO+2NO_2+\frac{1}{2}O_2\) (8)
\(4NO_2+O_2+2H_2O-->4HNO_3\) (9)
\(3X+4nHNO_3-->3X\left(NO_3\right)_n+nNO+2nH_2O\) (10)
viết ptr rồi, nhưng mik có thắc mắc là cho khí B hấp thụ vô nước => tính đc số mol của hno3, rồi áp vô X là ra, nhưng đề lại cho số mol NO =((( hoặc có thể dùng số mol NO để tính nhưng như thế có hơi thừa ko ? tính ra theo 2 cách thì cx ra 2 kq khác nhau ? ai githich giùm mik, hay mik tính sai hoặc phân tích đề sai nhỉ ?? :D

Phản ứng nhiệt nhôm không hoàn toàn nên ta không thể xác định được rõ sản phẩm Y gồm những chất nào. Ta quy đổi hỗn hợp Y thành X ( theo nguyên BTKL )
=> m = 0,02( 27 + 160) = 3,74 gam
Để đơn giản ta coi hỗn hợp X tác dụng với HNO3 loãng dư:
Các bán phản ứng Oxi hóa - khử:
\(Al\rightarrow Al^{3+}+3e\)
x--------------->3x
\(N^{+5}+3e\rightarrow N^{+2}\)
...........0,06<--0,02
\(\Rightarrow3x=0,06\Rightarrow x=0,02mol\)
\(m=m_{Al}+m_{Fe_2O_3}=27.0,02+160.0,02=3,74\) gam

Giải thích:
nAl = 0,4 mol ; nFe3O4 = 0,15 mol
Giả sử H = x
![]()
Bd: 0,4 0,15
Pu: 0,4x 0,15x 0,2x 0,45x
Sau: 0,4 – 0,4x 0,45x
nH2 = 1,5nAl + nFe → 0,48 = 1,5(0,4 – 0,4x) + 0,45x
→ x = 0,8
→ H = 80%
Đáp án D

Số mol HCl = V1 mol
Số mol NaOH = 2V2 mol
Trường hợp 1: Dung dịch X chứa HCl dư
HCl + NaOH → NaCl + H2O
2V2 2V2
3HCl + Al(OH)3 → AlCl3 + 3H2O
3a a
Số mol HCl = 2V2 + 3a = V1
Trường hợp 2: Dung dịch X chứa NaOH
HCl + NaOH → NaCl + H2O
V1 V1
Al(OH)3 + NaOH → NaAlO2 + 2H2O
a a
Số mol NaOH = V1 + a = 2V2

Số mol HCl = V1 mol
Số mol NaOH = 2V2 mol
Trường hợp 1: Dung dịch X chứa HCl dư
HCl + NaOH → NaCl + H2O
2V2 2V2
3HCl + Al(OH)3 → AlCl3 + 3H2O
3a a
Số mol HCl = 2V2 + 3a = V1
Trường hợp 2: Dung dịch X chứa NaOH
HCl + NaOH → NaCl + H2O
V1 V1
Al(OH)3 + NaOH → NaAlO2 + 2H2O
a a
Số mol NaOH = V1 + a = 2V2
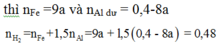
Đáp án A
Ta có : nAl = 10,8 / 27 = 0,4 mol ;
nFe3O4 = 34,8 / 232 = 0,15 mol ; n H2 = 10,752 / 22,4 = 0,48 mol
8 Al + 3 Fe3O4 → 4Al2O3 + 9 Fe
8x/3 x 3x
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒ hỗn hợp chất rắn Al dư, Fe3O4 dư , Al2O3 và Fe.
Theo phản ứng :
n Alp/ư = 8x/3 mol ⇒ nAldư = (0,4 - 8x/3) mol
2 Al + 3 H2SO4 → Al2(SO4)3 + 3H2
(0,4 - 8 3 x ) 3 2 0 , 4 - 8 3 x
Fe + H2SO4 → FeSO4 + H2
3x 3x
⇒ 3/2(0,4 - 8x/3) + 3x = 0,48 ⇒ x = 0,12 mol
⇒ H = 0,12/0,15 . 100% = 80%