Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
![]()
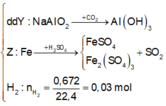
Giả sử Z + H2SO4 → dung dịch muối tạo thành chỉ có Fe2(SO4)3:
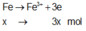
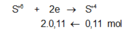
![]()
![]()
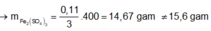
→ muối thu được gồm FeSO4 và Fe2(SO4)3.
Ta có sơ đồ phản ứng:
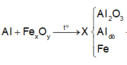
→ + N a O H d ư

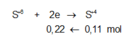
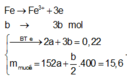
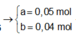
![]()
X tác dụng được với dung dịch NaOH tạo khí H2 →Al dư.
![]()
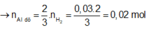
![]()
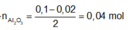
![]()
![]()
![]()
![]()

Đây là một câu khá khó trong đề thi chính thức của BGD, khó ở chỗ đề khá dài và nhiều phản ứng nối tiếp nhau.Tuy nhiên nếu bình tĩnh thì các bạn sẽ dễ dàng giải được bài toán này.
+ Tính các dữ liệu đã biết:

+ Sục khí CO2 dư vào Y, thu được 7,8 gam kết tủa, đó chính là Al(OH)3:
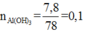
+ Thật cẩn thận và bình tĩnh để phân tích từng chi tiết của bài toán:
Cho X và NaOH dư, thu được H2 ⇒ Al dư, đồng nghĩa với việc oxit sắt là phản ứng hết.
Vậy X gồm A12O3, Al dư và Fe. Chất không tan Z là Fe.
+ Khi đã xác định được các chất X, Y, Z rồi thì chúng ta sẽ hệ thống và tóm tắt lại bài toán:
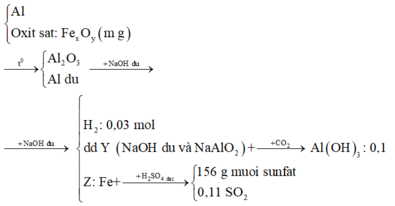
+ Sau khi đã tóm gọn được các dự liệu của bài toán, ta tiếp tục khai thác:
Từ 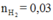 mol ⇒ Al dư
mol ⇒ Al dư
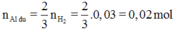
Có thể viết ra phương trình 2A1 + 2NaOH + 2H2O ⟶2NaAlO2 + 3H2
+ Vì tất cả Al đều đi vào kết tủa dưới dạng Al(OH)3 nên áp dụng định luật bảo toàn nguyên tố Al ta được:
![]()
⇒nAl phản ứng = 0,1 - 0,02 = 0,08 mol ⇒ n Al 2 O 3 = 0 , 04 mol
Vì oxit sắt phản ứng hết, Al dư nên lượng O có trong oxit sắt đã cùng với Al phản ứng đi hết vào trong Al2O3, do đó ta suy ra được
![]()
+ Vì đề bài chỉ hỏi m là khối lượng của oxit sắt (bao gồm sắt và oxi), ta đã tính được số mol oxi rồi nên bây giờ ta chỉ cần tìm khối lượng của sắt trong oxit, chú ý là toàn bộ lượng sắt trong oxit đều chuyển về Fe đơn chất (Z) nên ta sẽ khai thác ý sai của đề bài:
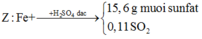
+ Ở đây có 2 cách giải để tìm số mol Fe:
Cách 1: Ta không thể biết được 15,6 gam muối sunfat đó là muối sắt II hay sắt III nên hướng giải tự nhiên là ta đặt ẩn phụ để giải:
Đặt
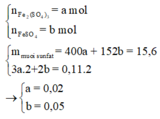
Chú ý là ta đã áp dụng phương pháp bảo toàn số mol electron:
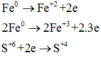
Do đó tổng số mol Fe là nFe = 2a + b = 0,09 mol
Vậy m = mFe +mO =0,09.56 + 0,12.16 = 6,96 gam.
Cách 2: Ta chỉ cần tìm số mol Fe nên có thể dùng ngay công thức giải nhanh sau:
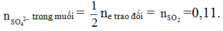
Mà 15,6 gam muối sunfat bao gồm ion những ion gì của sắt và định lượng của những ion này như thế nào ta không cần quan tâm:
![]()
Do đó: m = mFe + mO = 5,04 + 0,12.16 = 6,96 gam
Đáp án D

X + NaOH ⟶3/2 H2; nA1 = 0,02
CO2 + NaAlO2 + H2O ⟶ NaHCO3 + Al(OH)3
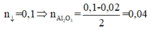
⇒ m = 10,26g
Đáp án A

Giải thích:
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH Giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Đáp án D

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2
=> X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol)
=> nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
