Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có
P+E+N=58 => 2Z+N=58
N-E=1 => -Z+N=1
=> Z = P=E 19 , N =20
=> tổng số hạt mang điện là P+E = 2Z = 38 => chọn B

Ta có: \(\left\{{}\begin{matrix}p+e+n=58+2=60\\p=e\\p+e-n=20\end{matrix}\right.\Leftrightarrow p=e=n=\dfrac{60}{3}=20\)
=> X là Canxi
Cấu hình electron: \(1s^22s^22p^63s^23p^64s^2\)
=> Có 4 lớp e nên ở chu kì 4, lớp e cuối cùng có 2e nên ở nhóm IIA, vị trí số 20

a) \(\left\{{}\begin{matrix}2Z+N=52\\2Z-N=16\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}Z=17\\N=18\end{matrix}\right.\)
b) \(\left\{{}\begin{matrix}2Z+N=95\\2Z-N=25\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}Z=30\\N=35\end{matrix}\right.\)

Đáp án A
Ion X2- có cấu trúc electron: 1s22s22p63s23p6
X + 2e → X2-
Vậy cấu hình electron của X là 1s22s22p63s23p4
X có 3 lớp electron → X thuộc chu kì 3.
X có số electron = 16 → X thuộc ô 16.
X có 6 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → X thuộc nhóm VIA.
• Nguyên tố Y có tổng số hạt cơ bản trong nguyên tử là 40. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12.
Giả sử số hiệu nguyên tử, số nơtron của Y lần lượt là Z, N
Ta có hpt: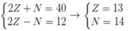
Cấu hình electron của Y là 13Y: 1s22s22p63s23p1
Y có 3 lớp electron → X thuộc chu kì 3.
Y có số electron = 13 → X thuộc ô số 13.
Y có 3 electron hóa trị, electron cuối cùng điền vào phân lớp 3p → Y thuộc nhóm IIIA.
• Ion Z2+ có tổng số hạt mang điện tích dương trong hạt nhân bằng 29.
Z có số hạt mang điện tích dương bằng ion Z2+
Cấu hình electron của Z là 29Z: 1s22s22p63s23p63d104s1
Z thuộc ô số 29.
Z có 4 lớp electron → X thuộc chu kì 4.
Z có electron cuối cùng điền vào phân lớp 3d, có 1 electron hóa trị → Z thuộc nhóm IB.
→ Chọn A.

Đáp án D
Ta có: ZM + ZX = (142 : 42) : 4 = 46.
2ZM – 2ZX = 12 (tổng số hạt mang điện là 2Z)
Dễ dàng tìm được ZM = 26, ZX = 20. Vậy M là Fe, X là Ca.

a: \(\left\{{}\begin{matrix}2Z+N=48\\2Z=2N\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}Z=16\\N=16\end{matrix}\right.\)
Số hiệu nguyên tử là 16
Số khối là 32
X là lưu huỳnh(S)
b: X là phi kim
Hóa trị cao nhất trong hợp chất với Oxi là 3
Hóa trị trong hợp chất với Hidro là 2



a)
Có p+n+e = 2p + n = 48
\(n=2p.50\%\)
=> p =n = e = 16
b)
Cấu hình của X: 1s22s22p63s23p4
=> X nằm ở ô thứ 16, chu kì 3, nhóm VIA