Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)

\(n_{H_2}=\dfrac{8.4}{22,4}=0,375\left(mol\right)\)
\(n_{O_2}=\dfrac{2.8}{22,4}=0,125\left(mol\right)\)
PTHH : 2H2 + O2 -> 2H2O
0,125 0,25
Ta thấy : 0,375 > 0,125 => H2 dư , O2 đủ
\(m_{H_2O}=0,25.18=4,5\left(g\right)\)
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{8,4}{22,4}=0,375mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{2,8}{22,4}=0,125mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,375 >0,125 ( mol )
0,125 0,25 ( mol )
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,25.18=4,5g\)

\(n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
\(n_{O_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,375}{2}>\dfrac{0,125}{2}\), ta được H2 dư.
Theo PT: \(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\Rightarrow m_{H_2O}=0,25.18=4,5\left(g\right)\)

nH2 = V/22,4 = 8,96/22,4 = 0,4 (mol)
nO2 = V/22,4 = 5,6/22,4 = 0,25 (mol)
PTHH: 2H2 + O2 --to--> 2H2O
Ta có: 0,4/2 < 0,25/1
=> O2 dư
Theo PTHH: nH2O = nH2 = 0,4 (mol)
=> mH2O = n.M = 0,4 . 18 = 7,2(g)

Số mol của 4,48 lít H2:
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
tỉ lệ: 2 : 1 : 2
0,2-> 0,1 : 0,2( mol)
a/ số gam của 0,2 mol nước:
\(m_{H_2O}=n.M=0,2.=3,6\left(g\right)\)
b/ thể tích của 0,1 mol khí O2:
\(V_{O_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)

\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\\ Vì:\dfrac{8,4}{2}>\dfrac{2,8}{1}\Rightarrow O_2hết,H_2dư\\ n_{H_2O}=2n_{O_2}=2.\dfrac{2,8}{24}=\dfrac{7}{30}\left(mol\right)\\ m_{H_2O}=\dfrac{7}{30}.18=4,2\left(g\right)\)

PTHH: \(4H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\n_{O_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{4}< \dfrac{0,125}{1}\) \(\Rightarrow\) Oxi còn dư, Hidro p/ứ hết
\(\Rightarrow n_{H_2O}=0,05\left(mol\right)\) \(\Rightarrow m_{H_2O}=0,05\cdot18=0,9\left(g\right)\)

PTHH: 2H2 + O2 -to-> 2H2O
Ta có: \(\dfrac{8,4}{2}>\dfrac{2,8}{1}\)
=> H2 dư, O2 hết nên tính theo \(V_{O_2}\)
Theo PTHH và đề bài, ta có:
\(m_{H_2O}=2.\dfrac{2,8}{22,4}.18=4,5\left(g\right)\)

Bài 1 :
a) \(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
b)
\(n_{O_2} = \dfrac{1}{2}n_{H_2} = \dfrac{1}{2}. \dfrac{6,72}{22,4} = 0,15(mol)\\ \Rightarrow V_{O_2} = 0,15.22,4 = 3,36(lít)\\ \Rightarrow m_{O_2} = 0,15.32 = 4,8(gam)\)

Phương trình hóa học của phản ứng tạo nước:
2H2 + O2 → 2H2O.
So sánh tỉ lệ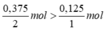 . Như vậy lượng H2 dư nên tính khối lượng nước sinh ra theo oxi.
. Như vậy lượng H2 dư nên tính khối lượng nước sinh ra theo oxi.
Theo phương trình trên ta có:
nH2O = 2. 0,125 = 0,25 mol.
mH2O = 0,25 .18 = 4,5g.