Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
b, \(n_{H_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,0625\left(mol\right)\Rightarrow V_{O_2}=0,0625.22,4=1,4\left(l\right)\)
\(n_{H_2O}=n_{H_2}=0,125\left(mol\right)\Rightarrow m_{H_2O}=0,125.18=2,25\left(g\right)\)
Số mol của 2,8 lít khí H2
nH2 = \(\dfrac{V}{22,4}\) = \(\dfrac{2,8}{22,4}\) = 0.125 mol
a. PTHH: 2H2 + O2 \(\rightarrow\) 2H2O
Tỉ lệ: 2 1 2
Mol: 0.125 \(\rightarrow\) 0.1 \(\rightarrow\) 0.125
b. Thể tích khí O2 ở đktc
VO2 = n . 22,4 = 0.1 . 22,4 = 2,24 (l)
Khối lượng H2O thu được
mH2O = n . M = 0.125 . 18 = 2,25g

\(a) Zn + 2HCl \to ZnCl_2 + H_2\\ b) n_{H_2} = n_{Zn} = \dfrac{14,3}{65} = 0,22(mol)\\ V_{H_2} = 0,22.22,4 = 4,928(lít)\\ b) n_{O_2} = \dfrac{3,36}{22,4}=0,15(mol)\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ \dfrac{n_{H_2}}{2} = 0,11 <\dfrac{n_{O_2}}{1} = 0,15 \to O_2\ dư\\ n_{O_2\ pư} = \dfrac{1}{2}n_{H_2} = 0,11(mol)\\ m_{O_2\ dư} = (0,15 - 0,11).32 = 1,28(gam)\\ n_{H_2O} = n_{H_2} = 0,22(mol) \Rightarrow m_{H_2O} = 0,22.18 = 3,96(gam)\)

Bài 1:
a, \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Theo PT: \(n_{CuO}=n_{Cu}=0,1\left(mol\right)\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=32-m_{CuO}=24\left(g\right)\)
Bài 2:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\), \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(n_{H_2O}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{H_2O}=0,1.18=1,8\left(g\right)\)
bài 1
a)PTHH:CuO+H2➞Cu+H2O
PTHH:Fe2O3+3H2➞2Fe+3H2O
b)nCuO=\(\dfrac{32}{80}\)=0,4(m)
nCu=\(\dfrac{6,4}{64}\)=0,1(m)
PTHH : CuO + H2 ➞ Cu + H2O
tỉ lệ :1 1 1 1
số mol
ban đầu:0,4 0,1
ta có tỉ lệ:\(\dfrac{0,4}{1}\)>\(\dfrac{0,1}{1}\)=>CuO dư
PTHH : CuO + H2 ➞ Cu + H2
số mol:0,1 0,1 0,1 0,1
m\(_{CuO}\)=0,1.80=8(g)
bài 2
n\(_{H_2}\)=\(\dfrac{2,24}{22,4}\)=0,1(m)
n\(_{O_2}\)=\(\dfrac{6,72}{22,4}\)=0,3(m)
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ : 2 1 2
số mol
ban đầu:0,1 0,3
ta có tỉ lệ:\(\dfrac{0,1}{2}\)<\(\dfrac{0,3}{1}\)=>O2 dư
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ :2 1 2
số mol:0,1 0,05 0,1
m\(_{H_2O}\)=0,1.18=1,8(g)

\(n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
\(n_{O_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,375}{2}>\dfrac{0,125}{2}\), ta được H2 dư.
Theo PT: \(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\Rightarrow m_{H_2O}=0,25.18=4,5\left(g\right)\)

\(n_{H_2}=\dfrac{8.4}{22,4}=0,375\left(mol\right)\)
\(n_{O_2}=\dfrac{2.8}{22,4}=0,125\left(mol\right)\)
PTHH : 2H2 + O2 -> 2H2O
0,125 0,25
Ta thấy : 0,375 > 0,125 => H2 dư , O2 đủ
\(m_{H_2O}=0,25.18=4,5\left(g\right)\)
\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{8,4}{22,4}=0,375mol\)
\(n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{2,8}{22,4}=0,125mol\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
0,375 >0,125 ( mol )
0,125 0,25 ( mol )
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,25.18=4,5g\)

\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\\ Vì:\dfrac{8,4}{2}>\dfrac{2,8}{1}\Rightarrow O_2hết,H_2dư\\ n_{H_2O}=2n_{O_2}=2.\dfrac{2,8}{24}=\dfrac{7}{30}\left(mol\right)\\ m_{H_2O}=\dfrac{7}{30}.18=4,2\left(g\right)\)

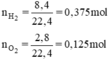
Phương trình hóa học của phản ứng tạo nước:
2H2 + O2 → 2H2O.
So sánh tỉ lệ 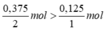 . Như vậy lượng H2 dư nên tính khối lượng nước sinh ra theo oxi.
. Như vậy lượng H2 dư nên tính khối lượng nước sinh ra theo oxi.
Theo phương trình trên ta có:
nH2O = 2. 0,125 = 0,25 mol.
mH2O = 0,25 .18 = 4,5g.
Bài 1 :
a) \(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
b)
\(n_{O_2} = \dfrac{1}{2}n_{H_2} = \dfrac{1}{2}. \dfrac{6,72}{22,4} = 0,15(mol)\\ \Rightarrow V_{O_2} = 0,15.22,4 = 3,36(lít)\\ \Rightarrow m_{O_2} = 0,15.32 = 4,8(gam)\)
Bài 2 :
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
Vì :\( \dfrac{n_{H_2}}{2} = \dfrac{8,4}{22,4.2} = 0,1875 > \dfrac{n_{O_2}}{1} = \dfrac{2,8}{22,4} =0,125\) nên Hidro dư
\(n_{H_2O} = 2n_{O_2} = 0,125.2 = 0,25(mol)\\ \Rightarrow m_{H_2O} = 0,25.18 = 4,5(gam)\)