Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do ở 2 TN, lượng CO2 thu được khác nhau
=> HCl hết trong cả 2 TN
TN1:
Na2CO3 + HCl --> NaCl + NaHCO3
a----------->a---------------->a
NaHCO3 + HCl --> NaCl + CO2 + H2O
________(b-a)------------->(b-a)
=> nCaCO3(TN1) = nCO2(TN1) = b-a (mol)
TN2:
Na2CO3 + 2HCl --> 2NaCl + CO2 + H2O
__________b------------------>0,5b
=> nCaCO3(TN2) = nCO2(TN2) = 0,5b
Do mCaCO3(TN1) = m; mCaCO3(TN2) = 2m
=> 2. nCaCO3(TN1) = nCaCO3(TN2)
=> 2(b-a) = 0,5b
=> 2b - 2a = 0,5b
=> 2a = 1,5b
=> a : b = 3 : 4


b.
3NaOH + FeCl3 → 3NaCl + Fe(OH)3↓
0,24 ← 0,08 → 0,08
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
0,42 ← 0,14 → 0,14
Sau pứ: nNaOHdư = 0,74 – (0,24 + 0,42) = 0,08
NaOH + Al(OH)3 → NaAlO2 + 2H2O
0,08 → 0,08
Dư: 0,06
Suy ra m↓ = mFe(OH)3 + mAl(OH)3 = 0,08 . 107 + 0,06 . 78 = 13,24g

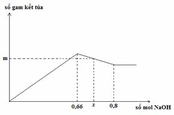
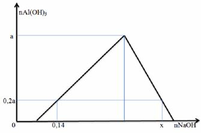
Vì nAl(OH)3 max = a → nAlCl3 = a
Giả sử số mol của AlCl3 và HCl trong mỗi phần là a, b
Bảo toàn Cl: 3a + b = 0,5 (1)
HCl + NaOH → NaCl + H2O
b → b
– Tại nNaOH = 0,14: kết tủa đang lên max (chưa bị hòa tan)
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
0,6a ← 0,2a
=> b + 0,6a = 0,14 (2)
Từ (1) và (2) => a = 0,15 và b = 0,05
– Tại nNaOH = x: kết tủa bị hòa tan một phần
Al(OH)3 + NaOH → NaAlO2 + 2H2O
0,12 → 0,12
Dư: 0,03
→ x = 0,05 + 3.0,15 + 0,12 = 0,62 (mol)
Vậy x = 0,62

Na2CO3 + HCl → NaCl + NaHCO3
a........................a..................................a...........................(mol)
NaHCO3 + HCl → NaCl + CO2 + H2O
0,5a...................0,5a..........................................................................(mol)
Hiện tượng : Ban đầu không có hiện tượng gì, sau một thời gian xuất hiện bọt khí không màu không mùi.

\(\left(1\right):NaOH\)
\(\left(2\right):BaCl_2\)
\(\left(3\right):H_2SO_4\)
\(\left(4\right):Na_2CO_3\)
\(\left(5\right):HCl\)
\(\left(6\right):MgCl_2\)
\(TN1:\)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(BaCl_2+Na_2CO_3\rightarrow BaCO_3+2NaCl\)
\(TN2:\)
\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
\(MgCl_2+Na_2CO_3\rightarrow MgCO_3+2NaCl\)
\(TN3:\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
1: \(NaOH\) 2: \(BaCl_2\) 3: \(H_2SO_4\) 4: \(Na_2CO_3\) 5: \(HCl\) 6: \(MgCl_2\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
\(BaCl_2+Na_2CO_3\rightarrow BaCO_3\downarrow+2NaCl\)
\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\)
\(MgCl_2+Na_2CO_3\rightarrow MgCO_3\downarrow+2NaCl\)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+CO_2\uparrow\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+H_2O+CO_2\uparrow\)

Bạn có thể làm rõ rõ một chút được không ạ ?? Mình cảm ơn.

1)Hiện tượng:xuất hiện kết tủa trắng xanh
PTHH: 2NaOH + CuSO4 ----> Cu(OH)2 + Na2SO42)Hiện Tượng:Khi cho giấy đồng vào dd AgNO3,một lúc sau ta thấy chất rắn màu xám(Ag) bám vào dây đồng , 1 phần dây đồng tan vào dd,dd ban đầu trong suốt chuyển sang màu zanh (đồng 2 nitrat)PTHH: Cu + 2AgNO3----> Cu(NO3)2 + 2Ag
Khi cho quỳ tím vào dung dịch NaOH thì quỳ tím chuyển thành màu xanh.
Sau đó nhỏ từ từ dung dịch H2SO4 thì quỳ dần chuyển về màu tím.
Khi lượng axit dư thì quỳ tím chuyển thành màu đỏ.
2NaOH + H2SO4 → Na2SO4 + 2H2O
a. Nhỏ từ từ dung dịch H3PO4 vào dung dịch NaOH:
H3PO4 + 3NaOH→Na3PO4+3H2O (1)
Vì \(\dfrac{0,12}{1}>\dfrac{0,2}{3}\) nên sau phản ứng (1), NaOH hết
=> nNa3PO4=\(\dfrac{1}{3}n_{NaOH}\)=\(\dfrac{1}{15}\) mol;
nH3PO4 phản ứng==\(\dfrac{1}{3}n_{NaOH}\)=\(\dfrac{1}{15}\) mol;
=> nH3PO4 dư=0,12−\(\dfrac{1}{15}\)=\(\dfrac{4}{75}\) mol
2Na3PO4+H3PO4→3Na2HPO4 (2)
Vì \(\dfrac{\dfrac{1}{15}}{2}< \dfrac{4}{75}\) nên sau phản ứng (2), Na3PO4 hết
nH3PO4 phản ứng=\(\dfrac{1}{2}\)nNa3PO4=\(\dfrac{1}{30}\) mol
=> nH3PO4 dư=\(\dfrac{4}{75}\) -\(\dfrac{1}{30}\) =\(\dfrac{1}{50}\) mol;
nNa2HPO4=\(\dfrac{3}{2}\)⋅nNa3PO4=0,1 mol
Na2HPO4+H3PO4→2NaH2PO4 (3)
Vì \(\dfrac{0,1}{1}>\dfrac{1}{\dfrac{50}{1}}\) nên sau phản ứng (3), H3PO4 hết
=> nNa2HPO4 phản ứng=nH3PO4=\(\dfrac{1}{50}\)mol
=> nNa2HPO4 dư=0,1−\(\dfrac{1}{50}\)=0,08 mol;
nNaH2PO4=2nH3PO4=0,04 mol
Vậy sau phản ứng thu được 0,08 mol Na2HPO4 và 0,04 mol NaH2PO4
b.Nhỏ từ từ dung dịch NaOH vào dung dịch H3PO4
H3PO4 + NaOH→NaH2PO4+H2O (1)
Vì \(\dfrac{0,12}{1}< \dfrac{0,2}{1}\) nên sau phản ứng (1), H3PO4 hết
=> nNaOH phản ứng=nH3PO4=0,12 mol
=> nNaOH dư=0,2−0,12=0,08 mol;
nNaH2PO4=nH3PO4=0,12 mol
NaH2PO4 + NaOH→Na2HPO4+H2O (5)
Vì \(\dfrac{0,08}{1}< \dfrac{0,12}{1}\) nên sau phản ứng (5), NaOH hết
=> nNaH2PO4 phản ứng=nNaOH=0,08 mol
=> nNaH2PO4 dư=0,12−0,08=0,04 mol;
nNa2HPO4=nNaOH=0,08 mol
Vậy sau phản ứng thu được 0,08 mol Na2HPO4 và 0,04 mol NaH2PO4