Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cả hai phản ứng trên, số oxi hóa của nito đều không đổi ( đều là phản ứng oxit hóa nội phân tử)
Trong hai phản ứng :
$NH_4^+$ đều là chất khử ( số hóa oxi hóa của N tăng từ -3 lên 0)
$NO_3^- , NO_3^-$ đều là chất oxi hóa ( số oxi hóa của N lần lượt giảm từ +3 xuống 0 và giảm từ +5 xuống +1)

S vừa có tính khử và tính OXH
\(H_2+S^0\underrightarrow{t^0}H_2S^{-2}\) ( Chất OXH )
\(S^0+O_{^2}\underrightarrow{t^0}S^{+4}O_{_{ }2}\) ( Chất Khử )
H2S chỉ thể hiện tính khử
\(2H_2S^{-2}+O_2^0\underrightarrow{t^0}2S^0+2H_2O\) ( Chất khử )
\(\)SO2 vừa có tính khử và tính OXH
\(2H_2S+S^{+4}O_2\underrightarrow{t^0}3S+2H_2O\) ( Chất OXH )
\(SO_2+\dfrac{1}{2}O_2\underrightarrow{t^0}SO_3\) ( Chất khử )
H2SO3 vừa có tính khử và tính OXH :
\(H_2SO_3+2H_2S\underrightarrow{t^0}3S+3H_2O\) ( Chất OXH )
\(5H_2SO_3+2KMnO_4\rightarrow2H_2SO_4+K_2SO_4+2MnSO_4+3H_2O\) ( Chất Khử )

Đáp án C
A. C + 4HNO3 đặc nóng → CO2 + 4NO2+ 2H2O
→Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
B. C +2 H2SO4 đặc nóng → CO2+ 2SO2+ 2H2O
→Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử
C. CaO + 3C→CaC2+ CO
→ Số oxi hóa của C tăng từ 0 lên +2 (trong CO) và giảm từ 0 xuống -1 (trong CaC2) nên C vừa là chất khử vừa là chất oxi hóa.
D. C + O2 → CO2
→Số oxi hóa của C tăng từ 0 lên +4 nên C là chất khử

A. C + 2HNO3 → CO2 + 4NO2 + 2H2O.
B. C + 2H2SO4 (đặc, nóng) → CO2 + 2SO2 + 2H2O.
C. CaO + 3C → CaC2 + CO. Trong phản ứng, C từ số oxi hóa là O lên số oxi hóa +2 và xuống số oxi hóa -1 → C vừa thể hiện tính khử, vừa thể hiện tính oxi hóa.
Đáp án C

Chọn D
N 2 đóng vai trò là chất oxi hóa khi tác dụng với kim loại và hiđro.
Vd:
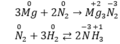

Chọn đáp án A.
- Ở TN1: MnO2 chỉ đóng vai trò là chất xúc tác để phản ứng nhiệt phân KClO3 nhiệt phân hoàn toàn tạo sản phẩm là KCl và O2.
- Ở TN2: MnO2 đóng vai trò là chất oxi hóa, có vai trò oxi hóa HCl để tạo khí Cl2 theo phản ứng sau:
M n + 4 O 2 + 4 H C l - 1 → t M n + 2 C l + C l 2 + 2 H 2 0 O