Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a)
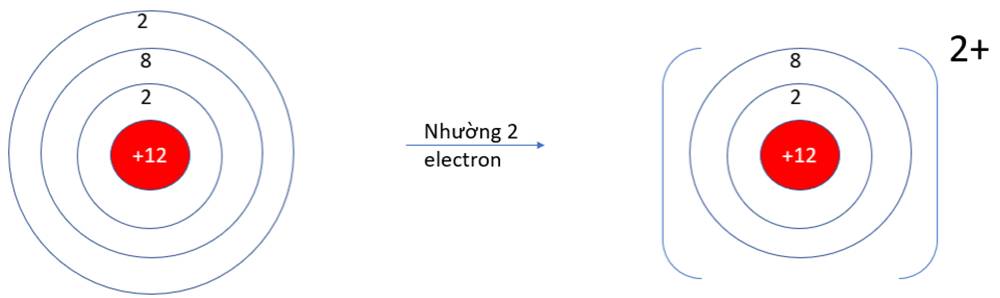
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

a) C, Si thuộc nhóm IVA, C thuộc chu kì 2, Si thuộc chu kì 3
=> C > Si
C,N thuộc chu kì 2, C thuộc nhóm IVA, N thuộc nhóm VA
=> N > C
KL: N > C > Si
b) O, S thuộc nhóm VIA, O thuộc chu kì 2, S thuộc chu kì 3
=> O > S
S,P thuộc chu kì 3, S thuộc nhóm VIA, P thuộc nhóm VA
=> S > P
KL: O > S > P
c) F, Cl thuộc nhóm VIIA, F thuộc chu kì 2, Cl thuộc chu kì 3
=> F > Cl
S,Cl thuộc chu kì 3, S thuộc nhóm VIA, Cl thuộc nhóm VIIA
=> Cl > S
KL: F > Cl > S
d) Si, S, P, Cl thuộc chu kì 3, Si thuộc nhóm IVA, P thuộc nhóm VA, S thuộc nhóm VIA, Cl thuộc nhóm VIIA
=> Cl > S>P>Si

\(a.CHecủaAl:1s^22s^22p^63s^23p^1\\ CHecủaS:1s^22s^22p^63s^23p^4\)
b.\(CHecủaMg:1s^22s^22p^63s^2\\ CHecủaO:1s^22s^22p^4\)
Do Mg có cấu hình e lớp ngoài cùng là 3s2
=> Có 2e lớp ngoài cùng (Kim loại), là nguyên tố s
Do O có cấu hình e lớp ngoài cùng là 2s22p4
=> Có 6e lớp ngoài cùng (Phi kim), là nguyên tố p
So sánh tính bazo của: Na2O, Al2O3, MgO, K2O. Giải thích
K2O>Na2O,>MgO>Al2O3
So sánh tính phi kim của: P, S, O, Cl. Giải thích?
Cl>O,>S> P
So sánh tính kim loại của: Ca, K, Mg. Giải thích?
K>Ca>Mg
Giải thích xem trên bản tuần hoàn nhé