Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D.
Dung dịch sau có màu xanh nhạt nghĩa là vẫn còn ít ion đồng ⟹ H+ chưa bị điện phân.
Gọi số mol Cu2+ điện phân là a (mol) còn số mol O2 tạo ra ở anot là b (mol).
Bảo toàn e suy ra: a = 2b
Khối lượng dung dịch giảm gồm khối lượng Cu và khối lượng khí oxi sinh ra nên:
64a + 32b = 0,64
Từ hai phương trình trên suy ra: b = 0,004 (mol); a =0,008 (mol).
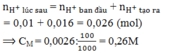

Đáp án D
![]()
Vì dung dịch Y vẫn còn màu xanh nên Y vẫn còn chứa Cu2+ chưa bị điện phân.
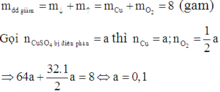
Khi cho Fe vào dung dịch Y có phản ứng:
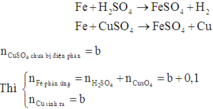
Theo định luật bảo toàn khối lượng, ta có:
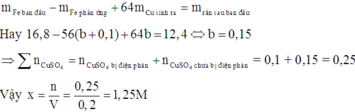

Giải thích: Đáp án A
ne = It/ F = 5. 96,5.60/96500 = 0,3 (mol)
Tại catot (-) Tại anot (+)
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,5 a→ a → 0,5a 0,15 ← 0,3
2H2O + 2e → H2 + 2OH-
b → 0,5b

Nồng độ của CuSO4 = a = 0,2 M

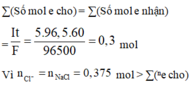
khối lượng dung dịch giảm chính là khối lượng của CuCl2 = x mol và HCl = y mol
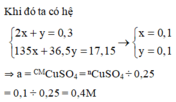
Đáp án A

Giải thích: Đáp án C
nMgCl2 = nNaCl = 0,2 mol => ∑nCl- = 0,2.2 + 0,2 = 0,6 mol
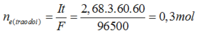
Tại catot: xảy ra quá trình oxi khử H2O Tại anot: Xảy ra quá trình oxi hóa Cl-
2H2O +2e → H2 + 2OH- 2Cl- → Cl2 + 2e
0,3 → 0,15 → 0,3 0,15←0,3
Khối lượng giảm = m↓ + m↑
= mMg(OH)2 + mH2 + mCl2
= 0,15.58 + 0,15.2 + 0,15.71 = 19,65g
Chú ý:
Tính khối lượng kết tủa của Mg(OH)2
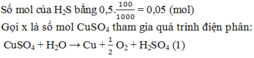
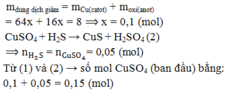





Đáp án B