Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

tham khảo
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron lớp ngoài cùng ⇒ Có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
- Nguyên tử H (Z = 1): 1s1 ⇒ Có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
⇒ Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O (góp chung 2 electron) tạo thành 2 cặp electron dùng chung
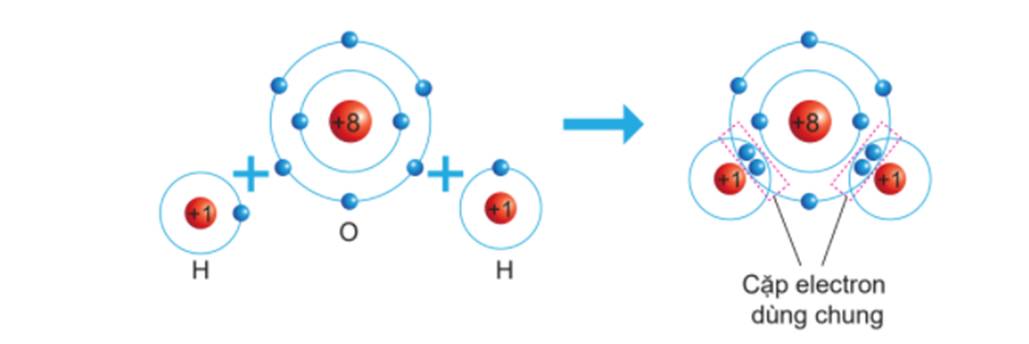

- Phân tử H2O được hình thành bởi 2 ion H+ và 1 ion O2-
- Nguyên tử nguyên tố hydrogen cho đi 1 electron tạo thành H+ để đạt cấu hình electron bền vững của khí hiếm
- Nguyên tử nguyên tố oxygen nhận 2 electron tạo thành O2- để đạt cấu hình electron bền vững của khí hiếm Ne

Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
Ví dụ:
- Phân tử O2
Khi hình thành liên kết hoá học trong phân tử O2, nguyên tử oxygen có 6 electron hoá trị, mỗi nguyên tử oxygen cần thêm 2 electron để đạt cấu hình electron bão hoà theo quy tắc octet nên mỗi nguyên tử oxygen góp chung 2 electron.
Phân tử O2 được biểu diễn như sau:


HD:
Độ âm điện của các nguyên tố như sau: H(2,2); F(3,98); Na(0,93); O(3,44).
HF: Hiệu độ âm điện giữa F và H = 3,98 - 2,2 = 1,78 > 1,7 nên liên kết H-F là liên kết ion.
Na2O: Hiệu độ âm điện giữa O và Na = 3,44 - 0,93 = 2,95 > 1,7 nên liên kết O-Na là liên kết ion.
NaOH: Hiệu độ âm điện O-H = 3,44 - 2,2 = 1,24 < 1,7 nên liên kết O-H là liên kết cộng hóa trị phân cực.
NaF: Hiệu độ âm điện = 3,98 - 0,93 = 3,05 > 1,7 nên liên kết Na-F là liên kết ion.

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
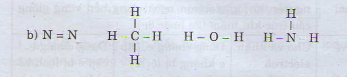
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

- Khi hình thành liên kết hóa học trong phân tử PH3, nguyên tử phosphorus có 5 electron hóa trị, nguyên tử phosphorus cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử hydrogen góp chung một 1 electron. Phân tử PH3 được biểu diễn
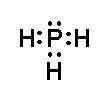
Xung quanh mỗi nguyên tử phosphorus đều có 8 electron.

Na2O, MgO, Al2O3
SiO2, P2O5, SO3
Cl2O7
∆X
2,51 2,13 1,83
( Liên kết ion )
1,54 1,25 0,86
( Liên kết cộng hóa trị có cực)
0,28
(Liên kết cộng hóa trị không cực)

- Phân tử CS2: Mỗi nguyên tử S sẽ góp 2 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung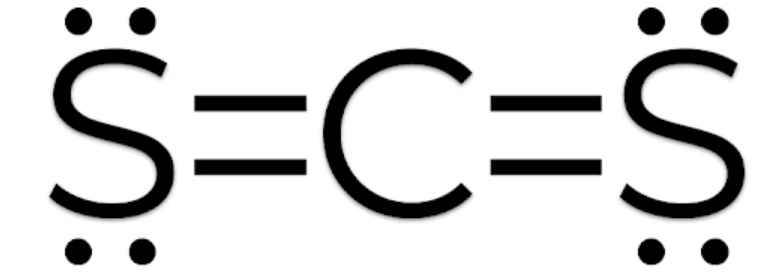
- Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử S góp 2 electron để tạo thành 2 cặp electron dùng chung
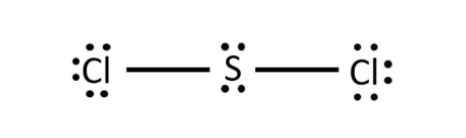
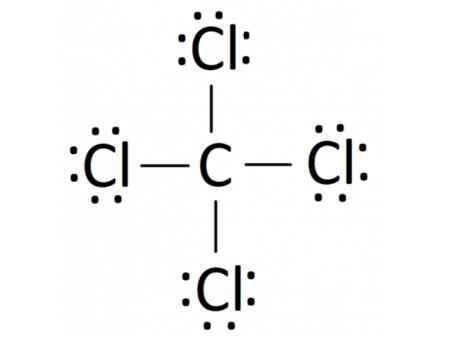
- Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung
Xung quanh mỗi nguyên tử fluorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử CCl4, nguyên tử carbon có 4 electron hóa trị, nguyên tử carbon cần thêm 4 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung một 1 electron. Phân tử CCl4 được biểu diễn
Xung quanh mỗi nguyên tử carbon và chlorine đều có 8 electron
- Khi hình thành liên kết hóa học trong phân tử NF3, nguyên tử nitrogen có 5 electron hóa trị, nguyên tử nitrogen cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử NF3 được biểu diễn
Xung quanh mỗi nguyên tử nitrogen và florine đều có 8 electron