Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Hiện tượng xảy ra:
+) Hỗn hợp bột sắt, lưu huỳnh cháy sáng.
+) Tạo chất rắn màu đen.
- Giải thích: Sắt tác dụng với lưu huỳnh tạo thành sắt (II) sunfua (màu đen).
- Thành phần của chất rắn trong ống nghiệm: Khối lượng sắt lớn hơn khối lượng lưu huỳnh.

Ta dùng năm châm hút sắt ra khỏi hỗn hợp vụn , còn lại nhôm và gỗ . Đem nhôm và gỗ cho vào nước , gỗ có khối lượng riêng nhẹ hơn nên nổi trên mặt nước , còn nhôm nặng hơn nên sẽ chìm xuống đáy
Chúc bạn học tốt

Bài 1:
| Đơn chất | Hợp chất |
| S, O2 | NaCl, MgSO4, KCl, P2O5 |
Bài 2:
a) AgNO3
CTHH AgNO3 mang ý nghĩa:
- Là hợp chất tạo bởi 3 nguyên tố hóa học : Ag , N và O
- Tạo bởi 1 nguyên tử nguyên tố Ag, 1 nguyên tử nguyên tố N và 3 nguyên tử nguyên tố O.
- \(PTK_{AgNO_3}=NTK_{Ag}+NTK_N+3.NTK_O\\ =108+14+3.16=170\left(đ.v.C\right)\)
b) KHSO4
CTHH KHSO4 mang ý nghĩa:
- Là hợp chất cấu tạo từ 4 nguyên tố hóa học: K,H,S và O
- Cấu tạo bởi 1 nguyên tử nguyên tố K, 1 nguyên tử nguyên tố H, 1 nguyên tử nguyên tố A và 4 nguyên tử nguyên tố O.
- \(PTK_{KHSO_4}=NTK_K+NTK_H+NTK_S+4.NTK_O\\ =39+1+32+4.16=136\left(đ.v.C\right)\)
Bài tập 3:
a) Gọi CT ghi hóa trị của S(IV) và O là \(S_x^{IV}O_y^{II}\)(x,y : nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(x.IV=y.II\\ =>\dfrac{x}{y}=\dfrac{II}{IV}=\dfrac{2}{4}=\dfrac{1}{2}\)
=> x=1; y=2
=> CTHH là SO2
b) Gọi CT ghi hóa trị của Al(III) và Cl(I) là \(Al_x^{III}Cl_y^I\) (x,y: nguyên, dương)
Theo quy tắc hóa trị ta có:
\(x.III=y.I\\ =>\dfrac{x}{y}=\dfrac{I}{III}=\dfrac{1}{3}\)
=> x=1; y=3
=> CTHH là AlCl3
Bài 4:
a) Gọi CT gọi hóa trị của hợp chất CuCl2 là \(Cu^aCl_2^b\)(a,b: nguyên, dương)
Theo Quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\)
=> a= II, b=I
=> Trong hợp chất CuCl2 : Cu(II) và Cl(I)
b) Gọi CT kèm hóa trị của hợp chất Fe(NO3)2 là: \(Fe^a\left(NO_3\right)_2^b\) (a,b: nguyên, dương)
Theo quy tắc hóa trị, ta có:
\(1.a=2.b\\ =>\dfrac{a}{b}=\dfrac{2}{1}=\dfrac{II}{I}\\ =>a=II;b=I\)
=> Trong hợp chất Fe(NO3)2 : Fe(II) và nhóm nguyên tử NO3 (I)

Phương trình hóa học:
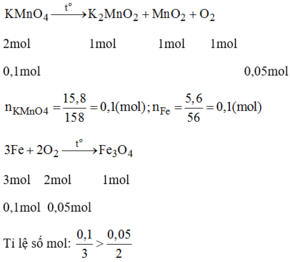
Vậy sắt còn dư nên khi đưa nam châm lại gần sản phẩm sau phản ứng thì nam châm bị hút.

2KMnO4 \(\xrightarrow[]{t^o}\) K2MnO4 + MnO2 + O2(1)
3Fe + 2O2 \(\xrightarrow[]{t^o}\) Fe3O4(2)
nKMnO4 = 15,8 : 158 = 0,1 mol
nFe = 5,6 : 56 = 0,1 mol
Theo pt 1 nO2 = \(\dfrac{1}{2}nKMnO_4=0,05mol\)
Lập tỉ lệ phương trình (2)
nFe : nO2 = \(\dfrac{0,1}{3}:\dfrac{0,05}{2}\)
Do 0,1/3 > 0,05/2 => Fe dư
Vậy sản phẩm thu được có Fe dư => bị nam châm hút