Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(A/PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(B/n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ n_{Fe}=a;n_{Zn}=b\\ \Rightarrow\left\{{}\begin{matrix}56a+65b=18,6\\a+b=0,3\end{matrix}\right.\\ \Rightarrow a=0,1;b=0,2\\ m_{Fe}=0,1.56=5,6g\\ m_{Zn}=18,6-5,6=13g\)

-Vì khối lượng hỗn hợp kim loại ở 2 trường hợp đều bằng nhau. Chỉ thay đổi lượng HCl. Do trường hợp 800ml HCl thì khối lượng chất rắn tăng lên nên nếu với 500ml HCl mà kim loại hết thì khi tăng lên 800ml HCl thì khối lượng chất rắn không thể tăng lên nữa nên:
-Trường hợp 500ml HCl thì hỗn hợp kim loại dư, HCl hết.
-Trường hợp 500ml HCl thì hỗn hợp kim loại hết, HCl dư.
-Ta sẽ tìm khối lượng mỗi kim loại trong trường hợp 800ml HCl:
-Gọi \(n_{Zn}=x;n_{Fe}=y\)
Zn+2HCl\(\rightarrow\)ZnCl2+H2
Fe+2HCl\(\rightarrow\)FeCl2+H2
Chất rắn thu được là ZnCl2 x mol và FeCl2 y mol
hệ: \(\left\{{}\begin{matrix}65x+56y=18,6\\136x+127y=39,9\end{matrix}\right.\)
giải ra x=0,2 và y=0,1
mZn=65.0,2=13gam; mFe=56.0,1=5,6gam
-Tính nồng độ mol HCl theo trường hợp 500ml HCl vì HCl phản ứng hết.
Cứ 1 mol hỗn hợp kim loại tạo 1 mol hỗn hợp muối thì tăng 71 gam
Vậy x mol hỗn hợp kim loại tạo x mol hỗn hợp muối thì tăng 34,575-18,6=15,975 gam
\(\rightarrow x=\dfrac{15,975}{71}=0,225mol\)
\(\rightarrow n_{HCl}=2x=0,45mol\rightarrow C_{M_{HCl}}=\dfrac{0,45}{0,5}=0,9M\)
Ngoài ra còn có thể tính cách khác nữa!bạn tự tham khảo nhé!

Do tính khử Zn > Fe nên Zn phản ứng trước.
Do khối lượng rắn khan ở thí nghiệm 2 > thí nghiệm 1.
Do đó, ở thí nghiệm 1 HCl hết, kim loại có thể dư. Ở thí nghiệm 2, kim loại hết, HCl có thể dư.
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{Zn} = a ; n_{Fe} = b\\ m_A = 65a + 56b = 18,6\\ m_{chất\ rắn} = 136a + 127b = 39,9\\ \Rightarrow a = 0,2; b = 0,1\\ \Rightarrow m_{Zn} = 0,2.65 = 13(gam) ; m_{Fe} = 0,1.56 = 5,6(gam)\)
Thí nghiệm 1 :
\(n_{Fe\ pư} = x(mol) ; n_{Fe\ dư} = y(mol)\\ \Rightarrow x + y = 0,1(1)\\ n_{FeCl_2} = x (mol)\\ \Rightarrow m_{chất\ rắn} = 0,2.136 + 127x + 56y = 34,575(2)\\ (1)(2)\Rightarrow x = 0,025 ; y = 0,075\\ n_{HCl} = 2n_{Zn} + 2n_{Fe\ pư} = 0,2.2 + 0,025.2 = 0,45(mol)\\ C_{M_{HCl}} = \dfrac{0,45}{0,5} = 0,9M\)

Chọn C.
\(n_{H_2}=0,4mol\)
\(\Rightarrow n_{HCl}=2n_{H_2}=0,8mol\)
\(C_M=\dfrac{0,8}{\dfrac{400}{1000}}=2M\)

Thí nghiệm 1 :
\(m_{Cl} = m_{muối} - m_{kim\ loại} = 5,82-2,98 = 2,84(gam)\\ \Rightarrow n_{HCl} = n_{Cl} = \dfrac{2,84}{35,5} = 0,08(mol)\\ \Rightarrow C_{M_{HCl}} = \dfrac{0,08}{0,2} = 0,4M\)
Thí nghiệm 2 :
\(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\Zn:b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\) 56a + 65b = 2,98(1)
\(\left\{{}\begin{matrix}FeCl_2:a\left(mol\right)\\ZnCl_2:b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\) 127a + 136b = 6,53(2)
(1)(2) suy ra: a = 0,03 ; b = 0,02
Vậy :
\(\%m_{Fe} = \dfrac{0,03.56}{2,98}.100\% = 56,38\%\\ \%m_{Zn} = 100\% -56,38\% = 43,62\%\)

2A+2aHCl->2ACla+aH2
2B+2bHCl->2BClb+aH2
nH2=0.3(mol)
->nHCl=0.3*2=0.6(mol)
->nCl/HCl=0.6(mol)
m muối khan=m kim loại+mCl/HCl=8+0.6*35.5=29.3(g)

a. PTHH:
Cu + HCl ---x--->
Fe + 2HCl ---> FeCl2 + H2
Vậy chất rắn A là Cu.
b. Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
=> \(\%_{m_{Fe}}=\dfrac{16,8}{30}.100\%=56\%\)
\(\%_{m_{Cu}}=100\%-56\%=44\%\%\)
c.
Theo PT: \(n_{FeCl_2}=n_{Fe}=0,3\left(mol\right)\)
=> \(m_{FeCl_2}=0,3.127=38,1\left(g\right)\)
d.
Ta có: \(m_{dd_{FeCl_2}}=100+16,8=116,8\left(g\right)\)
=> \(C_{\%_{FeCl_2}}=\dfrac{38,1}{116,8}.100\%=32,62\%\)
ta có Cu ko phản ứng với HCl
-> V khí là do Fe phản ứng hết tạo ra
Fe + 2HCl -> FeCl2 + H2
0,3 .............................0,3
n H2 = 6,72 : 22,4=0,3 mol
m Fe = 0,3.56 =16,8 g
% Fe = 16,8 : 30 .100 = 56 %
% Cu = 100% - 56% = 44%
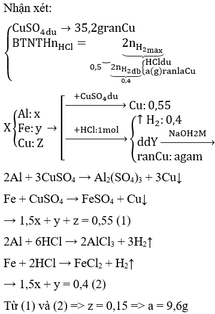
Đặt x,y lần lượt là số mol của Zn,Fe
*TN1 :đề sai nha em!!!
*TN2 :nH2=6.72/22.4=0.3 mol
Zn + 2HCl --> ZnCl2 + H2(1)
x 2x x
Fe + 2HCl --> FeCl2 + H2(2)
y 2y y
Theo pthh,ta có hệ pt: 65x + 56y = 18.6
x+y= 0.3
giải hệ trên,ta được :x=0.2,y=0.1
a)=>nHCl=0.4+0.2=0.6 mol
CM HCl=0.6/1=0.6 M
b) mZn=65*0.2=13g
mFe=56*0.1=5.6g
đề này rất đúng , chỉ cần xét về số l h2 thoát ra là được . bài này rất dễ