Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
4AgNO3 + 2H2O → d p 4Ag + 4HNO3 + O2
Dung dịch sau điện phân chứa AgNO3 dư = 0,3–x và HNO3 = x mol
Thấy mAg tối đa = 0,3 × 108 = 32,4 < 34,28g → chứng tỏ chất rắn chứa Ag :0,3-x và Fe dư :y
Có nNO = nHNO3 ÷ 4 = 0,25x mol
Bảo toàn electron → 2nFe pư = 3nNO + nAg.
⇒ nFe pư = ( 3×0,25x + 0,3-x) : 2 = 0,15-0,125x
→ 108×(0,3-x) + 22,4 – 56×(0,15-0,125x) = 34,28 ⇒ x = 0,12 mol
⇒ Thời gian điện phân t = 0 , 12 × 96500 2 , 68 × 3600 = 1,2 giờ

Đáp án D
Đặt nNO = x; nN2O = y ⇒ nZ = x + y = 0,005 mol; mZ = 30x + 44y = 0,005 × 19,2 × 2.
||⇒ giải hệ có: x = 0,002 mol; y = 0,003 mol || nMg dư = nH2 = 0,005 mol
⇒ nAg = (0,336 – 0,005 × 24) ÷ 108 = 0,002 mol. Đặt nMg phản ứng = a. Bảo toàn electron:
2nMg phản ứng = 3nNO + 8nN2O + 8nNH4NO3 + nAg ⇒ nNH4NO3 = (0,25a – 0,004) mol
||⇒ mmuối = 148a + 80.(0,25a – 0,004) = 3,04(g) ⇒ a = 0,02 mol. Lại có:
ne = nH+ = nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol ⇒ t = 2316(s)

Đáp án D
Vì Mg + dung dịch X → N2O và NO ⇒ X có chứa HNO3.
+ Nhận thấy 0,036 gam hỗn hợp kim loại chính là Ag và Mg.
⇒ X chứa AgNO3 dư và nMg dư = 0,005 mol ⇒ nAg = 0,002 mol
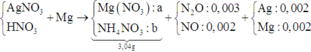
+ PT theo bảo toàn e ta có: 2nMg = nAg + 8nNH4+ + 8nN2O + 3nNO.
<=> 2a – 8b = 0,032 (1).
+ PT theo khối lượng muối: 148a + 80b = 3,04 (2).
+ Giải hệ (1) và (2) ⇒ nMg pứ = 0,02 và nNH4NO3 = 0,001.
⇒ Bảo toàn nitơ ta có nHNO3/X = 0,048 mol.
⇒ t = 0,048 × 96500 ÷ 2 = 2316s

Đáp án A
Vì Mg + dung dịch X → N2O và NO ⇒ X có chứa HNO3.
+ Nhận thấy 0,036 gam hỗn hợp kim loại chính là Ag và Mg.
⇒ X chứa AgNO3 dư và nMg dư = 0,005 mol ⇒ nAg = 0,002 mol
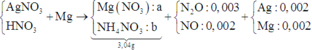
+ PT theo bảo toàn e ta có: 2nMg = nAg + 8nNH4+ + 8nN2O + 3nNO.
<=> 2a – 8b = 0,032 (1).
+ PT theo khối lượng muối: 148a + 80b = 3,04 (2).
+ Giải hệ (1) và (2) ⇒ nMg pứ = 0,02 và nNH4NO3 = 0,001.
⇒ Bảo toàn nitơ ta có nHNO3/X = 0,047 mol.
⇒ t = 0,047 × 96500 ÷ 2 = 2267,75s

nAl=0,09 mol
nFe3O4=0,04\(\rightarrow\)nFe=0,12
Sau khi cho tác dụng với HCl thu được FeCl2 a mol FeCl3 b mol AlCl3 0,09 mol
Giải HPT: \(\left\{{}\begin{matrix}\text{2a+3b+0,09.3=0,62}\\\text{a+b=0,12}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}\text{a=0,01}\\\text{b=0,11}\end{matrix}\right.\)
Ta có Ag+ +Cl- \(\rightarrow\)AgCl
nAgCl=nCl=0,62 mol
Ag+ +Fe2+\(\rightarrow\)Fe3+ +Ag
nAg=nFeCl2=0,01
\(\rightarrow\)m=90,05
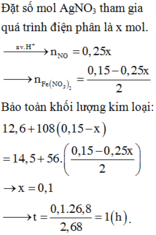

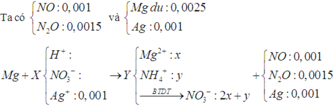
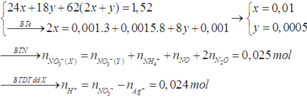
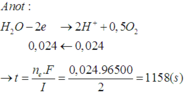
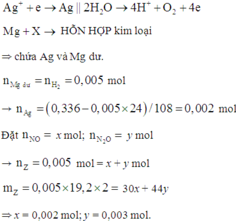
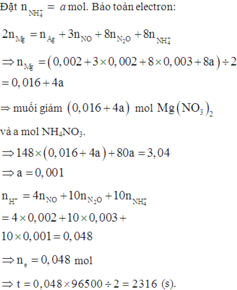
Đáp án C
xem dung dịch Y: bảo toàn 0,15 mol anion NO3–; Fe + Y → hỗn hợp kim loại + khí NO
||→ Y chứa cation Ag+ và H+. Quan sát sơ đồ bài tập HNO3:
BTKL kim loại: 12,6 + 108 × (0,15 – 4x) = 56 × (0,075 – ½.x) + 14,5 ||→ x = 0,025 mol.
||→ ne trao đổi = nH+ sinh ra = 4z = 0,1 mol ||→ thời gian t = 96500 × 0,1 ÷ 2,68 = 3600 (s) ⇄ 1 giờ.
||→ theo đó đáp án cần chọn là C.