Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình phản ứng hóa học:
CaCO3 CaO + CO2
a) Số mol CaCO3 cần dùng là:
Theo phương trình phản ứng hóa học, ta có:
= nCaO =
= 0,2 mol
Vậy cần dùng 0,2 mol CaCO3 để điều chế CaO
b) Khối lượng CaCO3 cần dùng để điều chế 7g CaO là:
Số mol: = nCaO =
= 0,125 mol
Khối lượng CaCO3 cần thiết là:
= M . n = 100 . 0,125 = 12,5 gam
c) Thể tích CO2 sinh ra:
Theo phương trình phản ứng hóa học, ta có:
= nCaO = 3,5 mol
= 22,4 . n = 22,4 . 3,5 = 78,4 lít
d) Khối lượng CaCO3 tham gia và CaO tạo thành:
= nCaO =
=
= 0,6 mol
Vậy khối lượng các chất: = 0,6 . 100 = 60 gam
mCaO = 0,6 . 56 = 33,6 gam

a/ nCaO = 11,2 : 56 = 02 mol
ptpư ; CaCO3 -----> CaO + CO2
1mol 1mol 1mol
x mol? 0,2 mol
thep ptpư ta thấy số mol CaCO3 cần dùng là
0,2x 1 : 1 = 0,2 mol
b/ câu b câu hỏi giống a tương tự Đáp số 0.125 mol
c/ theo ptpư trên thì nCaCO3 = nCO2
=> nCO2 = 3.5 mol => VCO2=3.5x22,4=78.4l
d/ ta có nCO2 = 13.44/22.4 =0.6 mol
ptpư : nCaCO3 = nCaO= n CO2 = 0.6
=> mCaCO3 = 0.6x100 = 60g ( tham gia )
mCaO = 0.6x56 =33.6 (tạo thành )

a) Ta có: \(n_{CaO}=\dfrac{11,2}{56}=0,2mol\)
_ Theo PTHH: \(n_{CaCO_3}=n_{CaO}=0,2mol\).
b) _ \(n_{CaO}=\dfrac{7}{56}=0,125mol\)
Theo PTHH: \(n_{CaO}=n_{CaCO_3}=0,125mol\)
=> \(m_{CaCO_3}=0,125.100=12,5\left(g\right)\)
c) Theo PTHH: _ \(n_{CaCO_3}=n_{CO_2}=3,5mol\)
=> \(V_{CO_2}=3,5.22,4=78,4\left(l\right)\)
d) _ \(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Theo PTHH : \(n_{CaCO_3}=n_{CaO}=n_{CO_2}=0,6mol\)
=> \(m_{CaCO_3}=0,6.100=60\left(g\right)\)
mCaO = 0,6 . 56 = 33,6 ( g) .

Phương trình hóa học CaCO3 → CaO + CO2.
a) nCaO = 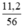 = 0,2 mol.
= 0,2 mol.
Theo PTHH thì nCaCO3 = nCaO = 0,2 (mol)
b) nCaO = 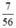 = 0,125 (mol)
= 0,125 (mol)
Theo PTHH thì nCaCO3 = nCaO = 0,125 (mol)
mCaCO3 = M.n = 100.0,125 = 12,5 (g)
c) Theo PTHH thì nCO2 = nCaCO3 = 3,5 (mol)
VCO2 = 22,4.n = 22,4.3,5 = 78,4 (lít)
d) nCO2 = 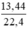 = 0,6 (mol)
= 0,6 (mol)
Theo PTHH nCaO = nCaCO3 = nCO2 = 0,6 (mol)
mCaCO3 = n.M = 0,6.100 = 60 (g)
mCaO = n.M = 0,6.56 = 33,6 (g)

Câu 1)
a) 2HgO\(-t^0\rightarrow2Hg+O_2\)
b)Theo gt: \(n_{HgO}=\frac{2,17}{96}\approx0,023\left(mol\right)\\ \)
theo PTHH : \(n_{O2}=\frac{1}{2}n_{HgO}=\frac{1}{2}\cdot0,023=0,0115\left(mol\right)\\ \Rightarrow m_{O2}=0,0115\cdot32=0,368\left(g\right)\)
c)theo gt:\(n_{HgO}=0,5\left(mol\right)\)
theo PTHH : \(n_{Hg}=n_{HgO}=0,5\left(mol\right)\\ \Rightarrow m_{Hg}=0,5\cdot80=40\left(g\right)\)
Câu 2)
a)PTHH : \(S+O_2-t^0\rightarrow SO_2\)
b)theo gt: \(n_{SO2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
theo PTHH \(n_S=n_{SO2}=0,1\left(mol\right)\\ \Rightarrow m_S=0,1\cdot32=3,2\left(g\right)\)
Ta có khối lượng S tham gia là 3,25 g , khối lượng S phản ứng là 3,2 g
Độ tinh khiết của mẫu lưu huỳnh là \(\frac{3,2}{3,25}\cdot100\%\approx98,4\%\)
c)the PTHH \(n_{O2}=n_{SO2}=0,1\left(mol\right)\Rightarrow m_{O2}=0,1\cdot32=3,2\left(g\right)\)

a) \(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Ta có: \(n_{CaCO_3}=n_{CaO}=0,2\left(mol\right)\)
b) \(n_{CaO}=\dfrac{7}{56}=0,125\left(mol\right)\)
Ta có : \(n_{CaCO_3}=n_{CaO}=0,125\left(mol\right)\)
=> \(m_{CaCO_3}=0,125.100=12,5\left(g\right)\)
c) \(n_{CO_2}=n_{CaCO_3}=3,5\left(mol\right)\)
=> \(V_{CO_2}=3,5.22,4=78,4\left(lít\right)\)
d) \(n_{CO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Ta có: \(n_{CO_2}=n_{CaCO_3}=n_{CaO}=0,6\left(mol\right)\)
=> \(m_{CaCO_3}=0,6.100=60\left(g\right)\)
\(m_{CaO}=0,6.56=33,6\left(g\right)\)

Bài 1:
3NaOH + FeCl3 → 3NaCl + Fe(OH)3↓
\(n_{NaOH}=\frac{20}{40}=0,5\left(mol\right)\)
a) Theo PT: \(n_{FeCl_3}=\frac{1}{3}n_{NaOH}=\frac{1}{3}\times0,5=\frac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=\frac{1}{6}\times162,5=27,083\left(g\right)\)
b) Theo pT: \(n_{NaCl}=n_{NaOH}=0,5\left(mol\right)\)
\(\Rightarrow m_{NaCl}=0,5\times58,5=29,25\left(g\right)\)
Theo pT: \(n_{Fe\left(OH\right)_3}=n_{FeCl_3}=\frac{1}{6}\left(mol\right)\)
\(\Rightarrow m_{Fe\left(OH\right)_3}=\frac{1}{6}\times107=17,83\left(g\right)\)
Bài 2:
CaCO3 \(\underrightarrow{to}\) CaO + H2O
a) \(n_{CaO}=\frac{11,2}{56}=0,2\left(mol\right)\)
Theo PT: \(n_{CaCO_3}=n_{CaO}=0,2\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,2\times100=20\left(g\right)\)
b) \(n_{CaO}=\frac{35}{56}=0,625\left(mol\right)\)
Theo PT: \(n_{CaCO_3}=n_{CaO}=0,625\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,625\times100=62,5\left(g\right)\)
c) Theo pT: \(n_{CO_2}=n_{CaCO_3}=0,5\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,5\times22,4=11,2\left(l\right)\)
d) \(n_{CO_2}=\frac{33,6}{22,4}=1,5\left(mol\right)\)
Theo pT: \(n_{CaCO_3}=n_{CO_2}=1,5\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=1,5\times100=150\left(g\right)\)
Theo pT: \(n_{CaO}=n_{CO_2}=1,5\left(mol\right)\)
\(\Rightarrow m_{CaO}=1,5\times56=84\left(g\right)\)

PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
a) Theo PT: \(n_{CaCO_3}pư=n_{CO_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}pư=0,1\times100=10\left(g\right)\)
b) Theo PT: \(n_{HCl}pư=2n_{CO_2}=2\times0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{HCl}pư=0,2\times36,5=7,3\left(g\right)\)
c) Theo PT: \(n_{CaCl_2}=n_{CO_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{CaCl_2}=0,1\times111=11,1\left(g\right)\)


sao bn hk lên mạng kiếm ak
a)PTHH: CaCO3 \(\underrightarrow{t^o}\) CaO + CO2
nCaO = 11,2 / 56 = 0,2 mol
=> nCaCO3 = nCaO = 0,2 mol
=> mCaCO3 = 0,2 x 100 = 20 gam
b) nCaO = 7 / 56 = 0,125 mol
=> nCaCO3 = nCaO = 0,125 mol
=> mCaCO3 = 0,125 x 100 = 1,25 gam
c) nCO2 = nCaCO3 = 3,5 mol
=> VCO2(đktc) = 3,5 x 22,4 = 78,4 lít