Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nBr2=0,05 mol
SO2 + Br2 + H2O =>H2SO4 +2HBr
0,05 mol<=0,05 mol
Chỉ có Cu pứ vs H2SO4 đặc nguội
Cu =>Cu+2 +2e
0,05 mol<= 0,1 mol
S+6 +2e =>S+4
0,1 mol<=0,05 mol
=>nCu=0,05 mol=>mCu=3,2g
=>mAl=5,9-3,2=2,7g
=>nAl=0,1 mol
Tổng nhh cr=0,1+0,05=0,15 mol

2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
nAl=0,2(mol)
Theo PTHH ta có:
nH2=nH2SO4=\(\dfrac{3}{2}\)nAl=0,3(mol)
mH2SO4=98.0,3=29,4(g)
VH2=22,4.0,3=6,72(lít)

\(SO_2+Br_2+2H_2O--->H_2SO_4+2HBr\)
\(\Rightarrow\)SO2 làm nhạt màu dung dich nước brom
\(SO_2+2H_2S--->3S\downarrow+2H_2O\)
\(\Rightarrow\)Xuất hiện kết tủa vàng Lưu huỳnh (S).
\(CuO+H_2SO_4--->CuSO_4+H_2O\)
\(\Rightarrow\)Chất rắn màu đen Đồng (II) oxit CuO tan dần trong dung dịch.

nFe = 0,24 (mol)
*TH1: H2SO4 đặc còn dư sau phản ứng
2Fe + 6H2SO4 (đặc) -t\(^o\)-> Fe2(SO4)3 + 3SO2 + 6H2O (1)
0,24..............................................0,12
Theo (1) nFe2(SO4)3 = 0,12 (mol)
=> m muối = 0,12 . 400 = 48 (g) > 42,24 (g)
=> Loại
*TH2: H2SO4 tác dụng hết, Fe còn dư sau phản ứng với H2SO4.
Gọi a, b lần lượt là số mol của Fe pứ ở phương trình (2) và (3)
2Fe + 6H2SO4 (đặc) -t\(^o\)-> Fe2(SO4)3 + 3SO2 + 6H2O (2)
a..........3a...................................0,5a.............1,5a
Fe + Fe2(SO4)3 ---> 3FeSO4 (3)
b......................................3b
Ta có: a + b = 0,24 (I)
0,5a.400 + 3b.152 = 42,24 (II)
Từ (I) và (II) ta được: b < 0 (loai)
Chịu :V Chỉ là lúc đầu định hình ra cách giải, nhưng nghiệm thế này thì khó
Bài này ra 2 muối sắt cơ. Là FeSO4 và Fe2(SO4)3
Do H2SO4 đặc hết, Fe dư nên xẩy ra pứ
Fe + Fe2(SO4)3 \(\rightarrow\)3FeSO4

Giải:
a) Số mol của H2 là:
nH2 = V/22,4 = 0,4 (mol)
Gọi nFe = x (mol)
và nMg = y (mol)
PTHH: Fe + H2SO4(l) -> FeSO4 + H2↑
---------x----------x------------x---------x-
PTHH: Mg + H2SO4 -> MgSO4 + H2↑
-----------y-------y-----------y----------y--
Ta có hệ phương trình:
\(\left\{{}\begin{matrix}m_{Fe}+m_{Mg}=16\left(g\right)\\n_{H_2}=0,4\left(mol\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}56x+24y=16\left(g\right)\\x+y=0,4\left(mol\right)\end{matrix}\right.\)
Giải hệ phương trình ta được:
\(\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
Khối lượng Fe là:
mFe = n.M = 0,2.56 = 11,2 (g)
\(\Rightarrow\) %mFe = (mFe/mhh) .100 = (11,2/16).100 = 70(%)
=> %mMg = 100-70 = 30(%)
b) Khối lượng dung dịch sau phản ứng là:
mddspư = mhh + mddH2SO4 - mH2 = 16+200-2.0,4 = 215,2 (g)
=> C%FeSO4 = (mFeSO4/mddspư).100 = (0,2.152/215,2).100 ≃ 14,13 (%)
=> C%MgSO4 = (mMgSO4/mddspư).100 = (0,2.120/215,2).100 ≃ 11,15 (%)
c) Vì H2SO4 là dung dịch nên không là chất khí, không thể áp dụng công thức V=22,4.n
Vì vậy chỉ dùng được công thức V=m/D. Đề bài chưa cho D nên mình sẽ cho DH2SO4 = 1,25 (g/cm khối) (Theo dữ kiện từ các bài khác).
Thể tích H2SO4 là:
VH2SO4 = m/D = (n.M)/D = (0,4.98)/1,25 = 31,36 (cm khối)
Đáp số: ...
Bạn ơi giải hộ mình 2 bài trong trang mình nữa ạ!!! Cảm ơn bạn nhiều!!!
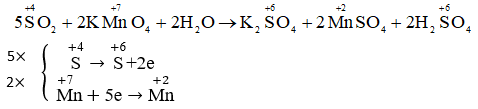
A. Kẽm bột sẽ tiếp xúc với H2SO4 nhiều hơn nên tốc độ phản ứng nhanh hơn
B. Thêm 50 ml H2SO4 nhưng với nồng độ không đổi thì không làm thay đổi tốc độ phản ứng.
C. Thay bằng H2SO4 có nồng độ thấp hơn thì phản ứng sẽ xảy ra chậm hơn
D. Đun nóng dung dịch làm tốc độ phản ứng nhanh hơn
→ Đáp án B