Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Công thức của oxit là A l x O y
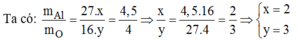
Vậy công thức hóa học của nhôm oxit là A l 2 O 3 .

a/ PTHH: 4Al + 3O2 ===> 2Al2O3
Áp dụng định luật bảo toàn khối lượng,
=> mO2 = mAl2O3 - mAl = 15 - 9 = 6 gam
b/ %mAl = \(\frac{27.2}{27.2+16.3}\) x 100% = 52,94%
a.Theo định luật bảo toàn khối lượng
mAl+mO2=mAl2O3
=>mO2=mAl2O3-mAl=15-9=6(g)
b.%mAl=\(\dfrac{27.2}{27.2+16.3}.100\%\)=52,94%
Chúc bạn học tốt![]()

Áp dụng định luật bảo toàn khối lượng :
=>m O2=51-27=24g
b>
%Al=27.2\27.2+16.3 .100=52,94%
=>O=47,06%
c>
nếu nhôm lấn với sắt ta dùng nam châm hoặc dd Naoh

Khối lượng mol :
MKMnO4 = 39 + 55 + 64 = 158 (g/mol)
Số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất :
nK = 1 mol
nMn = 1 mol
nO = 4 mol
Khối lượng của mỗi nguyên tố có trong 1 mol hợp chất :
mK = 39.1 = 39 (g)
mMn = 55.1 = 55 (g)
mO = 16.4 = 64 (g)
Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất :
\(\%m_K=\frac{m_K}{M_{KMnO_4}}.100\%=\frac{39}{158}.100\%=24,7\%\)
\(\%m_{Mn}=\frac{m_{Mn}}{M_{KMnO_4}}.100\%=\frac{55}{158}.100\%=34,8\%\)
\(\%m_O=\frac{m_O}{m_{KMnO_4}}.100\%=\frac{64}{158}.100\%=40,5\%\)
Các bước giải bài toán xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất :
B1 : Tính khối lượng mol (M) của hợp chất.
B2 : Tính số mol nguyên tử của mỗi nguyên tố có trong 1 mol hợp chất.
B3 : Tính khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
B4 : Tính thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất.

Ta có CTTH: KClO3
=> Gọi CTTQ là K1Cl1O3
=> \(M_{KClO_3}=122,5\) (g/mol)
\(\%m_K=\dfrac{1
.
39}{122,5}
.
100\%=31,84\%\)
\(\%m_{Cl}=\dfrac{1
.
35,5}{122,5}
.
100\%=28,98\%\)
\(\%m_O=100\%-\left(\%m_K+\%m_{Cl}\right)=100\%-\left(31,84\%+28,98\%\right)=39,18\%\)
Phần trăm K trong KClO3: \(\%K=\dfrac{39}{39+35,5+16.3}.100=31,84\%\)
Phần trăm Cl trong KClO3: \(\%Cl=\dfrac{35,5}{39+35,5+16.3}.100=28,98\%\)
Phần trăm O trong KClO3: \(\%O=100-31,84-28,98=39,18\%\)

\(M_{Fe_3O_4}=56.3+16.4=232\left(\dfrac{g}{mol}\right)\)
\(\%Fe=\dfrac{56.3}{232}.100\%=72,4\%\)
\(\%O=\dfrac{16.4}{232}.100\%=27,862\%\)
tìm công thức hóa học của hợp chất có thàn phần các nguyên tố như sau:55,189%K; 14,623%P và còn lại là oxi.Biết 0,05 mol hợp chất có khối lượng là 10,6 gam

Ta có: MAl2O3 = 27.2+16.3 = 102 g/mol
%Al = 27.210227.2102.100% = 52,94%
%O = 16.310216.3102.100% = 47,06%
\(M_{Al_2O_3}\) phải ghi như vầy nhá