Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
Khối lượng CaO: 
Số mol CaO:
Pt:
 số mol Ca (OH)2
số mol Ca (OH)2
Vậy khối lượng Ca(OH)2tạo thành: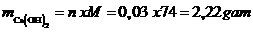
Vậy mct = 2,22 gam
 Mà
Mà 
Vậy nồng độ phần trăm Ca(OH)2: 
Câu 2:
+ Khối lượng riêng  khối lượng dd H2SO4 là
khối lượng dd H2SO4 là 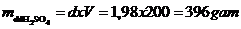
+ 
Số mol CuO: 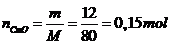
 Pt:
Pt: 

 Khối lượng
Khối lượng 
Vậy khối lượng chất tan: mct = 24 gam
Mà 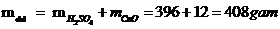
Vậy nồng độ phần trăm: 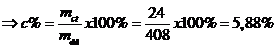

ZnO + H2SO4 = ZnSO4 + H2O
0.1mol:2.32mol
=> H2SO4 dư theo ZnO
=> khối lượng axits tham gia: 0,1.(2+32+16.4)=9.8g
=> khối lượng muối : mZnSO4=0.1(65+32+16.4)=16.1g
nồng độ mol sau pu: CM=\(\frac{0.1}{0.58}\)=\(\frac{5}{29}\)

a,Khi cho hỗn hợp kim loại gồm Fe và Ag tác dụng với H2SO4(loãng) thì có các pthh có thể xảy ra;
Fe+H2SO4(loãng)\(\rightarrow\)FeSO4+H2(1)
b,Vì kim loại Ag đứng sau H trong dãy hoạt đông hóa học thì không phản ứng với axit H2SO4(loãng) để giải phóng khí H2 nên chất rắn sau pư là :Ag kim loại
\(\rightarrow\)mAg=1,08(g) mà nH2=6,72;22,4=0,3(mol)
theo đề bài mFe(đề bài)=20-1,08=18,92(g)
nFe(pư 1)=nH2(sinh ra)=0,3(mol)
mFe(pư 1)=56\(\times\)0,3=16,8(g)
mà 16,8<18,92(g) nên Fe dư H2SO4 pư hết
theo trên:mFe=18,92(g)\(\Rightarrow\)%m Fe=\(\dfrac{18,92}{20}\)\(\times\)100%=94,6%
% mAg=100%-94,6%=5,4%
Vậy %m Fe=94,6%;% m Ag=5,4%
c, ở phần này bạn sai đề vì đây phải là H2SO4 phải là pư chứ
nH2SO4 pư(1)=0,3(mol)(vì Fe dư nên H2SO4 pư hết)
CM dd H2SO4=\(\dfrac{0,3}{0,6}\)=0,5(M)
Vậy CM của dd H2SO4 là 0,5(M)

Giải:
a) Số mol Na2SO3 là:
nNa2SO3 = n/M = 12,6/126 = 0,1 (mol)
PTHH: Na2SO3 + H2SO4 -> Na2SO4 + H2O + SO2↑
-------------0,1------0,1--------------0,1----0,1-------0,1--
Khối lượng chất tan H2SO4 là:
mctH2SO4 = n.M = 0,1.98 = 9,8 (g)
Nồng độ phần trăm của dd H2SO4 là:
C%H2SO4 = (mct/mdd).100 = (9,8/200).100 = 4,9 %
=> a = 4,9
Thể tích SO2 thu được ở đktc là:
VSO2 = 22,4.n = 22,4.0,1 = 2,24 (l)
b) Khối lượng dd sau phản ứng là:
mddspư = mNa2SO3 + mddH2SO4 - mSO2 = 12,6 + 200 - 6,4 = 206,2 (g)
Nồng độ phần trăm dd sau phản ứng là:
C%Na2SO4 = (mct/mddspư).100 = (142.0,1/206,2).100 ≃ 6,88 %
Vậy ...

Bài 1: \(n_{H_2SO_4}=\frac{9}{49}\left(mol\right)\)
H2SO4 + 2KOH -> K2SO4 + 2H2O
=> nKOH= 2nH2SO4 = \(\frac{18}{49}\left(mol\right)\)
=> Vdd KOH = \(\frac{18}{49}:\frac{2}{1000}=\frac{9000}{49}\left(ml\right)\)
b) nK2SO4 = nH2SO4 = \(\frac{9}{49}\left(mol\right)\)
=> mK2SO4= \(\frac{9}{49}\cdot174=\frac{1566}{49}\left(g\right)\)
mdd KOH = \(\frac{9000}{49}\cdot1,12=\frac{1440}{7}\left(g\right)\)
c) \(\%m_{K_2SO_4}=\frac{1566}{49}:\left(200+\frac{1440}{7}\right)\cdot100\%\approx7,87\%\)
bài 2: nNa2CO3 = 0,05 (mol)
PTHH:
Na2CO3 + 2HCl -> 2NaCl + H2O + CO2
=> nHCl = n NaCl = 2nNa2CO3 = 0,1 (mol)
=> mNaCl= 0,1 . 58,5 = 5,85 (g)
b) nCO2 = nNa2CO3 = 0,05 (mol)
=> mCO2 = 0,05 . 44 = 2,2 (g)
mdd HCl = 0,1 . 36,5 :20% = 18,25 (g)
=> %mNaCl = \(\frac{5,85}{53+18,25-2,2}\approx8,47\%\)

bài 5 a) CuO + 2HCl --> CuCl2 + H2O
ZnO + 2HCl --> ZnCl2 + H2O
b/Gọi số mol CuO và ZnO lần lượt là x,y
nHCl= 0,3mol
Có 80x+ 81y=12,1
2x+2y= 0,3
<=>x=0,05 và y=0,1
mCuO=0,05*80=4g=>%CuO=4*100/12,1=33%
%ZnO= 67%
c/Nếu dùng H2SO4 => viết pt thấy nH2SO4 = 1/2nHCl=0,15mol
mH2SO4 = 0,15*98=14,7g=>mddH2SO4 = 14,7*100/20=73,5g
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
Zn+H2SO4\(\rightarrow\)ZnSO4+H2
- Ta có: \(n_{Zn}=n_{H_2}=0,2mol\)
mZn=0,2.65=13g\(\rightarrow\)mCu=20-13=7g
\(n_{H_2SO_4}=0,2mol\)
C%\(=\dfrac{0,2.98.100}{196}=10\%\)
a)
PTHH : 2Al + 3H2SO4 ----> Al2(SO4)3 + 3H2
b) nAl = \(\dfrac{m}{M}=\dfrac{13,5}{27}=0,5\left(mol\right)\)
=> nH2SO4 cần dùng = \(\dfrac{0,5\cdot3}{2}=0,75\left(mol\right)\)
=> mH2SO4 cần dùng = 0,75 . 98 =73,5 (g)
b) \(mdd_{H_2SO_4}=\dfrac{73,5\cdot100}{19,6}=375\left(g\right)\)
=> mdd sau phản ứng = mAl + mddH2SO4 - mH2
= 13,5 + 375 - 0,75 . 2 =387(g)
mAl2(so4)3 = 0,25 . 342 =85,5 (g)
\(\Leftrightarrow C\%=\dfrac{85,5}{387}\cdot100\%=22,1\%\)
HOK TỐT NHÉ -_-