Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(m_{H_2SO_4}=100.9,8\%=9,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PTHH: CuO + H2SO4 → CuSO4 + H2O
Mol: 0,05 0,05 0,05
Ta có: \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\) ⇒ CuO hết, H2SO4 dư
\(C\%_{ddCuSO_4}=\dfrac{0,05.160.100\%}{4+100}=7,69\%\)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,1-0,05\right).98.100\%}{4+100}=4,71\%\)

Câu 1:
Khối lượng CaO: 
Số mol CaO:
Pt:
 số mol Ca (OH)2
số mol Ca (OH)2
Vậy khối lượng Ca(OH)2tạo thành: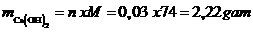
Vậy mct = 2,22 gam
 Mà
Mà 
Vậy nồng độ phần trăm Ca(OH)2: 
Câu 2:
+ Khối lượng riêng  khối lượng dd H2SO4 là
khối lượng dd H2SO4 là 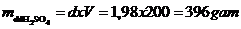
+ 
Số mol CuO: 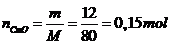
 Pt:
Pt: 

 Khối lượng
Khối lượng 
Vậy khối lượng chất tan: mct = 24 gam
Mà 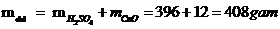
Vậy nồng độ phần trăm: 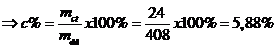

a)
PTHH : 2Al + 3H2SO4 ----> Al2(SO4)3 + 3H2
b) nAl = \(\dfrac{m}{M}=\dfrac{13,5}{27}=0,5\left(mol\right)\)
=> nH2SO4 cần dùng = \(\dfrac{0,5\cdot3}{2}=0,75\left(mol\right)\)
=> mH2SO4 cần dùng = 0,75 . 98 =73,5 (g)
b) \(mdd_{H_2SO_4}=\dfrac{73,5\cdot100}{19,6}=375\left(g\right)\)
=> mdd sau phản ứng = mAl + mddH2SO4 - mH2
= 13,5 + 375 - 0,75 . 2 =387(g)
mAl2(so4)3 = 0,25 . 342 =85,5 (g)
\(\Leftrightarrow C\%=\dfrac{85,5}{387}\cdot100\%=22,1\%\)
HOK TỐT NHÉ -_-

H2SO4+Ba(OH)2-----------> BaSO4 + 2H2O
1..................1(mol)
a) Ta có
mH2SO4=250.24%=60(g)
nH2SO4=\(\frac{60}{98}\)=0,612(mol)
mBa(OH)2=250.20%=50(g)
nBa(OH)2=\(\frac{50}{171}\)=0,292(mol)
Ta có: \(0,612>0,292\)
=>H2SO4 dư
Theo pthh
nH2SO4=nBa(OH)2=0,292(mol)
Theo ĐLBKL:
mdd trc pư= mddsau pứ=250+250=500(g)
C%=\(\frac{0,292.98}{500}.100\%=5,72\left(\%\right)\)

a, - Gọi khối lượng dd H2SO4 vừa đủ là x ( g, x > 0 )
=> \(m_{H_2SO_4}=\frac{C\%.m_{dd}}{100\%}=\frac{12,25\%.x}{100\%}=0,1225x\left(g\right)\)
=> \(m_{H_2O}=m_{dd}-m_{H_2SO_4}=x-0,1225x=0,8775x\left(g\right)\)
=> \(n_{H_2SO_4}=\frac{m}{M}=0,00125x\left(mol\right)\)
PTHH : \(MCO_3+H_2SO_4\rightarrow MSO_4+H_2O+CO_2\)
.............0,00125x..0,00125x......0,00125x............0,00125x.......
=> Sau phản ứng thu được dung dịch MSO4 .
Ta có : \(m_{dd}=m_{MCO_3}+m_{ddH_2SO_4}-m_{CO_2}\)
\(=0,00125x\left(M_M+60\right)+x-0,00125x.44\)
\(=0,00125M_Mx+1,02x=0,00125x\left(M_M+816\right)\)
Ta có : \(m_{MSO_4}=n.M=0,00125x.\left(M_M+96\right)\)
Ta có : \(C\%_{MSO_4}=\frac{0,00125x\left(M_M+96\right)}{0,00125x\left(M_M+816\right)}.100\%=17,431\%\)
=> \(\frac{M_M+96}{M_M+816}=0,17431\)
=> \(M_M\approx56\left(đvc\right)\)
Vậy công thức hóa học là \(FeCO_3\)
b, PTHH : \(FeCO_3+H_2SO_4\rightarrow FeSO_4+H_2O+CO_2\)
=> Sau phản ứng thu được dung dịch muối tạo thành là FeSO4 .
PTHH : \(FeSO_4+nH_2O\rightarrow FeSO_4.nH_2O\)
\(n_{tinhthể}=\frac{m}{M}=\frac{33,36}{152+18n}\left(mol\right)\)
=> \(n_{FeSO_4}=\frac{33,36}{152+18n}\left(mol\right)\)
=> \(m_{FeSO_4}=n.M=\frac{5070,72}{152+18n}\left(g\right)\)
Ta lại có : \(m_{FeSO_4}=\frac{C\%m_{dd}}{100\%}=18,24\left(g\right)\)
=> \(\frac{5070,72}{152+18n}=18,24\)
=> \(n=7\left(TM\right)\)
Vậy công thức của tinh thể là \(FeSO_4.7H_2O\) .



\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(m_{ct}=\dfrac{9,8.100}{100}=9,8\left(g\right)\)
\(n_{H2SO4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
0,05 0,1 0,05
Lập tỉ số so sánh : \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\)
⇒ CuO phản ừng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
\(n_{CuSO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{CuSO4}=0,05.160=8\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,05.98=4,9\left(g\right)\)
\(m_{ddspu}=4+100=104\left(g\right)\)
\(C_{CuSO4}=\dfrac{8.100}{104}=7,69\)0/0
\(C_{H2SO4\left(dư\right)}=\dfrac{4,9.100}{104}=4,71\)0/0
Chúc bạn học tốt