Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nAg = 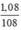 = 0,01 mol
= 0,01 mol
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen
NaX + AgNO3 → AgX↓ + NaNO3
0,01mol 0,01mol
2AgX → 2 Ag + X2
0,01mol 0,01mol
Theo pt: nNaX = nAgX = nAg = 0,1 mol
MNaX = 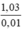 = 103 → X = 103 – 23 = 80 (Br)
= 103 → X = 103 – 23 = 80 (Br)
Muối A có công thức phân tử là NaBr

Chọn đáp án B
NaY + A g N O 3 → N a N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,01 (mol)
=> 0,01(23 + M Y ) = 1,03 => M Y = 80 (Br)

Chọn đáp án B
NaY + A g N O 3 → A g N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,03 (mol
0,03(23+ M Y ) = 3,09 => M Y = 80 (Br)

Đáp án A
nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
![]() , MX =80 (Br)
, MX =80 (Br)

Gọi muối A có công thức tổng quát dạng NaX. ( X thuộc nhóm VIIA - halogen - là nguyên tử khối, là kí hiệu tổng quát)
PTHH: NaX+AgNO3→AgX+NaNO3 (1)
1(mol) --------------> 1(mol)
AgX→Ag+X (2)
1(mol)---> 1(mol)
Theo đề, ta có: nNaX=1,0323+X(mol);nAg=1,08/108=0,01(mol)
Theo 2 phương trình:nNaX=nAgX=nAg⇔1,0323+X=0,01⇔X=80
Vậy X là Br (Brom).
Vậy muối A là NaBr: Natri Bromua.
\(NaX+AgNO_3\rightarrow NaNO_3+AgX\)
\(2AgX\rightarrow2Ag+X_2\)
\(n_{Ag}=\frac{1,08}{108}=0,1\left(mol\right)\)
\(\rightarrow n_{NaX}=n_{Ag}=0,1\left(mol\right)\)
\(M_{NaX}=\frac{1,03}{0,01}=103\left(\frac{g}{mol}\right)\)
\(\rightarrow M_X=80\)
Vậy X là Brom

Tăng giảm khối lượng ta có; $n_{NaX}=\frac{2,35-1,5}{108-23}=0,01(mol)$
$\Rightarrow M_{NaX}=150\Rightarrow X=127$
Vậy CTHH của muối là NaI
Bảo toàn nguyên tố X và Ag ta có: $n_{AgNO_3}=n_{AgI}=0,01(mol)\Rightarrow C_{M}=1M$
PTHH: \(NaX+AgNO_3\rightarrow NaNO_3+AgX\downarrow\)
Theo PTHH: \(n_{NaX}=n_{AgX}\)
\(\Rightarrow\dfrac{1,5}{23+X}=\dfrac{2,35}{108+X}\) \(\Leftrightarrow X=127\) (Iot)
\(\Rightarrow\) Công thức: NaI
Ta có: \(n_{AgNO_3}=n_{NaI}=\dfrac{1,5}{150}=0,01\left(mol\right)\)
\(\Rightarrow C_{M_{AgNO_3}}=\dfrac{0,01}{0,01}=1\left(M\right)\)

nAgX = nAg = 1,08 / 108 = 0,01 mol.
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen.
NaX + AgNO3 \(\rightarrow\) AgX + NaNO3.
2AgX \(\rightarrow\) 2Ag + X2.
nNaX = 0,01.
MNaX = 1,03 / 0,01 = 103.
X = 103 – 23 = 80 (Br).
Muối A có công thức phân tử là NaBr.
gọi công thức hóa học của muối natri halogenua là NaX NaX + AgNO3 =AgX +NaNO3 (1) 2 AgX= 2Ag + X2 (2) theo (1) va (2) ta có: \(\dfrac{1,03}{23+X}=0,01\) X=80 g/mol vậy A là NaBr

Đáp án C
Gọi công thức muối là CaX2
CaX2 + 2AgNO3 → Ca(NO3)2 +2AgX
40+2X 2.(108+X)
0,2 0,376
Ta có → X=80 (Br)
Công thức. CaBr2

nAg=0,01 mol
NaX+AgN03------->NaN03+AgX,áp dụng bảo toàn nguyên tố Ag,nAg sau=nAg truoc
0,01--------------------------------0,01
MNaX=1,03/0,01=103------------------->X=80------->Br
NaBr nhe