Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHNO3 ban đầu = 1,425
MX = 32,8; Sử dụng sơ đồ đường chéo ⇒ n NO = 0,2 ; n N2O = 0,05
Ta có nNO3- trong muối kl = ne = 8nN2O + 8nNH4NO3
Bảo toàn nguyên tố N: nHNO3 ban đầu = n NO + 2n N2O + 2n NH4NO3 + n NO3- trong muối KL
⇒ nHNO3 ban đầu = 4 nNO + 10 nN2O + 10 nNH4NO3
⇒ nNH4NO3 = 0,0125
⇒ nNO3-/muối KL= 1,1
⇒ m = mNO3-/muối kl + mKL + mNH4NO3 = 1,1.62 +29 + 0,0125.80 = 98,2g
Đáp án A.

nHNO3 ban đầu = 1,425
MX = 32,8; Sử dụng sơ đồ đường chéo ⇒ n NO = 0,2 ; n N2O = 0,05
Ta có nNO3- trong muối kl = ne = 8nN2O + 8nNH4NO3
Bảo toàn nguyên tố N: nHNO3 ban đầu = n NO + 2n N2O + 2n NH4NO3 + n NO3- trong muối KL
⇒ nHNO3 ban đầu = 4 nNO + 10 nN2O + 10 nNH4NO3
⇒ nNH4NO3 = 0,0125
⇒ nNO3-/muối KL= 1,1
⇒ m = mNO3-/muối kl + mKL + mNH4NO3 = 1,1.62 +29 + 0,0125.80 = 98,2g
Đáp án A.

\(\text{Đ}\text{ặt}:n_{Al}=a\left(mol\right);n_{Cu}=b\left(mol\right)\left(a,b>0\right)\\ Al+6HNO_3\rightarrow Al\left(NO_3\right)_3+3NO_2+3H_2O\\ Cu+4HNO_3\rightarrow Cu\left(NO_3\right)_2+2NO_2+2H_2O\\ \Rightarrow\left\{{}\begin{matrix}27a+64b=7,75\\3.22,4a+2.22,4b=7,84\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\\ a,\Rightarrow\%m_{Al}=\dfrac{0,05.27}{7,75}.100\approx17,419\%\\ \Rightarrow\%m_{Cu}\approx82,581\%\\ b,n_{HNO_3}=6a+4b=0,7\left(mol\right)\\ C_{M\text{dd}HNO_3}=\dfrac{0,7}{0,14}=5\left(M\right)\)

\(3Ag+4HNO_3\rightarrow3AgNO_3+NO+2H_2O\)
\(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
\(NO\) là sản phẩm khử duy nhất.
\(\Rightarrow n_{NO}=\dfrac{0,448}{22,4}=0,02mol\)
Ta có: \(\left\{{}\begin{matrix}27n_{Al}+108n_{Ag}=3,51g\\BTe:3n_{Al}+n_{Ag}=3n_{NO}=0,06\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,01mol\\n_{Ag}=0,03mol\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{0,01\cdot27}{3,51}\cdot100\%=7,7\%\)
\(\%m_{Ag}=100\%-7,7\%=92,3\%\)

Td với H2SO4:
\(n_{H_2}=\dfrac{2,9748}{24,79}=0,12mol\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{Al}=\dfrac{0,12.2}{3}=0,08mol\)
Td với HNO3:
\(n_{Al}=a=0,08mol\\ n_{Cu}=b\)
Khí hoá nâu trong không khí → NO
\(n_{NO}=\dfrac{3,664}{24,79}=0,16mol\\ 3Cu+8HNO_3\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\\ Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
\(\Rightarrow a+\dfrac{2}{3}b=0,16\\ \Leftrightarrow0,08+\dfrac{2}{3}b=0,16\\ \Leftrightarrow b=0,12mol\\ \Rightarrow m=0,08.27+0,12.64=9,84g\)
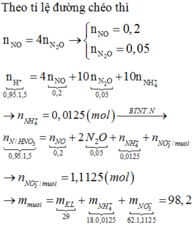
Gọi số mol của NO và N2O là a, b
nAl = 0,5 mol
Bt e : 3nAl = 3nNO + 8nN2O\(\Leftrightarrow\) 3a + 8b = 1,5 (1)
dhh/H2 = 19,2\(\rightarrow\) 30a + 44b = 19,2. 2. (a+b) (2)
Từ (1)(2)\(\rightarrow\)a = 0,1; b = 0,15
a) VNO = 2,24 lít ; VN2O = 3,36 lít
b) nHNO3 = 4n NO + 10nN2O = 1,9 mol
mHNO3 = 119, 7 gam
mdd HNO3 = 1,5. 2,2 . 1000 = 3300 gam
C%HNO3 =\(\frac{\text{119,7}}{3300}\). 100 = 3,62%
Gọi số mol của NO và N2O là a, b
nAl = 0,5 mol
Bt e : 3nAl = 3nNO + 8nN2O <=> 3a + 8b = 1,5 (1)
dhh/H2 = 19,2 => 30a + 44b = 19,2. 2. (a+b) (2)
Từ (1)(2) => a = 0,1; b = 0,15
a) VNO = 2,24 lít ; VN2O = 3,36 lít
b) nHNO3 = 4n NO + 10nN2O = 1,9 mol
mHNO3 = 119, 7 gam
mdd HNO3 = D. Vdd = 1,5. 2,2 . 1000 = 3300 gam
C%HNO3 = (119,7 : 3300). 100 = 3,62%