Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mình thay trên câu a luôn nhé.
5. Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
a) Ta có PTHH :
Fe + 2HCl \(\rightarrow\) FeCl2 + H2\(\uparrow\)
1 mol 2 mol 1 mol 1 mol
0,1 mol 0,2 mol 0,1 mol 0,1 mol
Số mol của Fe là :
nFe = 5,6/56 = 0,1 (mol)
b) Khối lượng của FeCl2 tạo thành sau p.ứng là :
mFeCl2 = 0,1.127 = 12,7 (g)
c) Thể tích khí Hiđro (đktc) tạo thành sau p.ứng là :
VH2 = 0,1.22,4 = 2,24 (l)
4. Công thức của B là : NaxCyOz
+ \(m_{Na}=\frac{106.43,6}{100}\approx46\left(g\right)\)
\(m_C=\frac{106.11,3}{100}\approx12\left(g\right)\)
\(m_O=\frac{106.45,3}{100}\approx48\left(g\right)\)
+ \(n_{Na}=\frac{46}{23}=2\left(mol\right)\)
\(n_C=\frac{12}{12}=1\left(mol\right)\)
\(n_O=\frac{48}{16}=3\left(mol\right)\)
Suy ra trong một p.tử h/c có 2 n.tử Na, 1 n.tử C và 3 n.tử O.
\(\Rightarrow\) CTHH của hợp chất B là Na2CO3.

a) Hợp chất CO có MCO = 12 + 16 = 28 g/mol
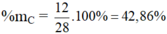
%mO = 100 – 42,86 = 57,14%
Hợp chất CO2: có MCO2 = 12 + 32 = 44 g/mol
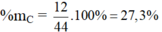
%mO = 100 – 27,3 = 72,7%
b) Hợp chất Fe3O4: MFe3O4 = 3.56 + 4.16 = 232 g/mol
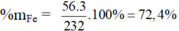
%mO = 100 – 72,4 = 27,6%
Hợp chất Fe2O3: MFe2O3 = 2.56 + 3.16 = 160 g/mol
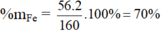
%mO = 100 – 70 = 30%
c) Hợp chất SO2 : MSO2 = 32 + 2.16 = 64 g/mol
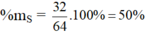
%mO = 100 – 50 = 50%
Hợp chất SO3 : MSO3 = 32 + 16.3 = 80 g/mol
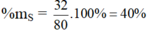
%mO = 100 – 40 = 60%

câu 4
MX= 8,5.2 = 17
gọi công thức NxHy
=> x:y = \(\frac{82,35}{14}:\frac{17,65}{1}=1:3\)
=> NH3

a) Fe2O3
b) %Fe = (2 .56).100%/160=70%
%O = 100% - 70% = 30 %
c) Trong 2 mol phân tử A có : 4 mol nguyên tử Fe và 6 mol nguyên tử O
a) Công thức hóa học của A: Fe2O3
b) \(\%m_{Fe}=\frac{56.2}{56.2+16.3}.100\%=70\%\)
\(\Rightarrow\%m_O=100\%-70\%=30\%\)
c) Trong 2 mol phân tử A có 4 mol Fe và 6 mol O

+ MH2SO4 = 2 + 32 + 16.4 = 98 (g/mol)
+ nH = 2 mol
nS = 1 mol
nO = 4 mol
+ mH = 2.2 = 4 g
mS = 1.32 = 32 g
mO = 4.16 = 64 g
%mH = \(\frac{2}{98}.100\%=2,04\%\)
%mS = \(\frac{32}{98}.100\%=32,65\%\)
%mO = 100% - 2,04% - 32,65% = 65,31%
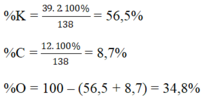
\(a,\%Cu=\dfrac{m_{Cu}}{M_{CuSO_4}}=\dfrac{64}{160}=40\%\\ \%S=\dfrac{m_S}{M_{CuSO_4}}=\dfrac{32}{160}=20\%\\ \%O=100\%-\%Cu-\%S=100\%-40\%-20\%=40\%\)
\(b,\%Fe=\dfrac{m_{Fe}}{M_{Fe_3O_4}}=\dfrac{168}{232}=72,41\%\\ \%O=100\%-\%Fe=100\%-72,41\%=27,59\%\)
\(c,\%Fe=\dfrac{m_{Fe}}{M_{FeO}}=\dfrac{56}{72}=77,77\%\\ \%O=100\%-\%Fe=100\%-77,77\%=22,23\%\)
\(d,\%K=\dfrac{m_K}{M_{K_2SO_3}}=\dfrac{78}{138}=56,52\%\\ \%C=\dfrac{m_C}{M_{K_2SO_4}}=\dfrac{12}{138}=8,69\%\\ \%O=100\%-\%K-\%C=100\%-56,52\%-8,69\%=34,79\%\)
a) \(M_{CúSO_4}=64+32+16.4=160\left(DvC\right)\)
\(m_{Cú}=\dfrac{64}{160}.100\%=40\%\)
\(m_S=\dfrac{32}{160}.100\%=20\%\)
\(m_O=\dfrac{16.4}{160}.100\%=40\%\)