Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lâu lắm rồi mới ngoi lên lại với cuộc thi và tiêu chí mới, trong kì thi lần này không biết là các bạn có muốn lồng ghép thêm 1 chút kiến thức Sinh học vào không ta?
Mng ơi, các bạn có thể đóng góp cho mình về các hình thức thi cũng như đề hay nha :3

Quy đổi hh thành Fe và O
Đặt nFe=a(mol);nO=b(mol); nSo2=c(mol).
=> \(56a+16b=69.6\)(1)
Bảo toàn e => \(3a-2b-2c=0\)(2)
Kết tủa Fe(OH)3: \(n_{Fe\left(OH\right)_3}=0.7\left(mol\right)\)
=> \(n_{H^+_{\left(du\right)}}=1,55.2-0,7.3=1\left(mol\right)\)
=> \(n_{H_2SO_4\left(pu\right)}=2-0,5=1,5\left(mol\right)\)
=> \(b+2c=1,5\) (3)
Từ (1)(2) (3)
=> \(\left\{{}\begin{matrix}a=0,9\left(mol\right)\\b=1,2\left(mol\right)\\c=0,15\left(mol\right)\end{matrix}\right.\)=> \(V=3,36\left(l\right)\)
Quy đổi hỗn hợp ban đầu về a mol Fe; b mol O.
\(\Rightarrow56a+16b=69,6\left(1\right)\)
TN1: Cho hỗn hợp td H2SO4
\(n_{H_2SO_4}=2\left(mol\right)\)
QT nhường e: Fe -----> Fe+3 + 3e
____________a\(_{\rightarrow}\)______________3a
QT nhận e: O + 2e ------> O-2
__________b\(_{\rightarrow}\)__2b
S+6 + 2e -----> S+4
______3a+2b____\(_{\leftarrow}\frac{3a+2b}{2}\)
TN2: Cho Y td NaOH
Sau pứ ta có Fe(OH)3 ; Fe2(SO4)3(dư); Na2SO4
\(n_{NaOH}=3,1\left(mol\right);n_{Fe\left(OH\right)_3}=0,7\left(mol\right)\\ BTNT.Na\Rightarrow n_{Na_2SO_4}=\frac{1}{2}n_{NaOH}=1,55\left(mol\right)\\ BTNT.Fe\Rightarrow n_{Fe}=2n_{Fe_2\left(SO_4\right)_3\left(du\right)}+n_{Fe\left(OH\right)_3}\\ \Rightarrow n_{Fe_2\left(SO_4\right)_3\left(du\right)}=\frac{a-0,7}{2}\left(mol\right)\\ \\ BTNT.S\Rightarrow n_{H_2SO_4}=3n_{Fe_2\left(SO_4\right)_3\left(du\right)}+n_{SO_2}+n_{Na_2SO_4}\\ \Rightarrow2=1,5\left(a-0,7\right)+\frac{3a-2b}{2}+1,55\left(2\right)\)
(1) và (2) => \(\left\{{}\begin{matrix}a=0,9\\b=1,2\end{matrix}\right.\)
\(\Rightarrow n_{SO_2}=0,15\left(mol\right)\Rightarrow V=3,36\left(l\right)\)

Theo anh thì 1,3,4 co tác dụng với nhau nên k cùng tồn tại trong 1 dung dịch nhưng không có đáp án đó.

Hai lí do chính :
Trong lòng biển và đại dương tồn tại cân bằng hoá học :
![]()
Theo nguyên lí chuyển dịch cân bằng, khi nồng độ cacbon đioxit tăng thì cân bằng hoá học chuyển theo chiều thuận, do đó làm giảm nồng độ của cacbon đioxit.
- Sự quang hợp của cây xanh trên lục địa và của tảo ở biển và các đại dương :
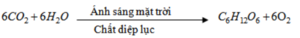
Dù cho có những quá trình tự điều tiết, khống chế sự tăng cacbon đioxit, nhưng con người đang thải lượng cacbon đioxit ngày càng nhiều hơn, vượt quá khả năng tự điều chỉnh của thiên nhiên.

Các bạn chú ý bảng của mình ở mục nhận xét chấm thi của vòng 1 nhé!
Lên rồi nhé :))