Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Cấu hình electron của N (Z = 7): 1s22s22p3
- Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử N đều cần thêm 3 electron. Vì vậy mỗi nguyên tử N cùng góp 3 electron để tạo nên 3 cặp electron chung cho 2 nguyên tử N.
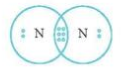
⟹ Số cặp electron dùng chung là 3.
⟹ Công thức Lewis của N2:
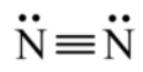

vì X2Y3 có 50e => 2Zx + 3Zy = 50
lại có Zx nhiều hơn Zy 5e => Zx = 13, Zy = 8
=> X:Al, Y:O
cấu hình e X: 1s22s22p63s23p1.
cấu hình e Y: 1s22s22p4

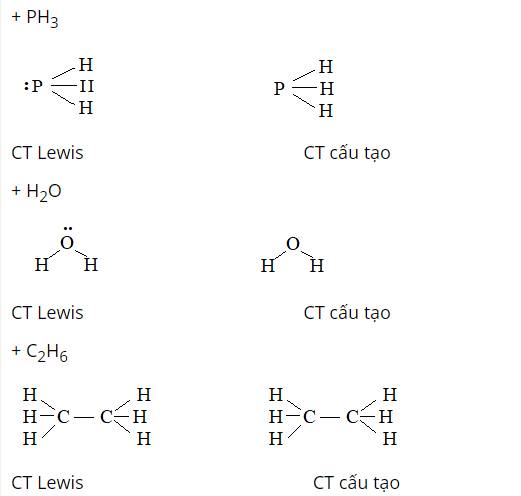
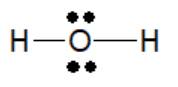
Giữa 3 phân tử H2O, PH3 và C2H6, nguyên tử O có độ âm điện lớn hơn cả nên liên kết trong H2O là phân cực mạnh nhất.

- Phân tử CS2: Mỗi nguyên tử S sẽ góp 2 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung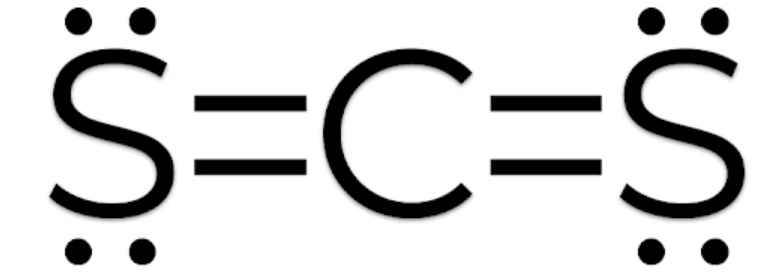
- Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử S góp 2 electron để tạo thành 2 cặp electron dùng chung
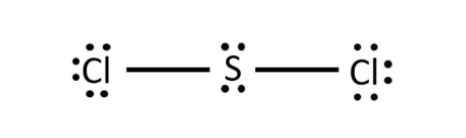
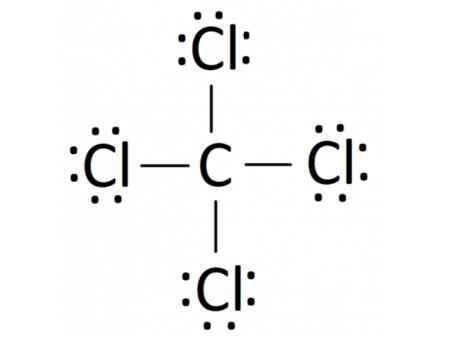
- Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron và nguyên tử C góp 4 electron để tạo thành 4 cặp electron dùng chung

F O Cl N
Độ âm điện: 3,98 3,44 3,16 3,14
Nhận xét: tính phi kim giảm dần.
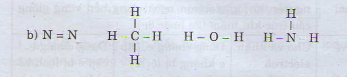
N2 CH4 H2O NH3
Hiệu độ âm điện: 0 0,35 1,24 0,84
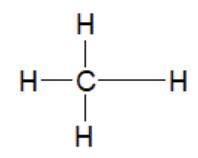
Phân tử N2, CH4 có liên kết cộng hóa trị không phân cực. Phân tử H2O có liên kết cộng hóa trị phân cực mạnh nhất trong dãy.

- Trong phân tử HCl, Cl có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử Cl
- Trong phân tử NH3, N có độ âm điện lớn hơn H => Cặp electron chung lệch về phía nguyên tử N
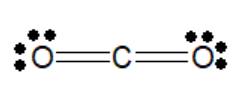
- Trong phân tử CO2, O có độ âm điện lớn hơn C => Cặp electron chung lệch về phía nguyên tử O