Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
xét 1 mol nguyên tủ Crom: có số nguyên tử Crom là 6.022. 10 23 nguyên tử và khối lượng là 52.
Thể tích của 1 mol nguyên tử Crom là:
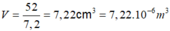
Thể tích thực của 1 nguyên tử Crom là:
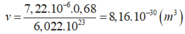
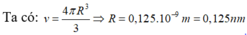

Giả sử có 1 mol nguyên tử Mg thì chứa 6,02. 1023 nguyên tử Mg
Thể tích của 1 mol nguyên tử Mg là V=
24
,
305
1
,
74
Ta có Vnguyên tử =
V
6
,
02
.
10
23
Gọi cạnh của hình lập phương là a cm. Vì các nguyên tử Mg là hình cầu nội tiếp trong các hình lập phương nên bán kính của nguyên tử Mg là r= 0,5a
Ta có thể tích của hình lập phương là a3 = (2r)3=
V
6
,
02
.
10
23
→ 8r3 =
24
,
305
1
,
74
.
6
,
03
.
10
23
→ r = 1,42. 10-8 cm = 0,142 nm.
Đáp án C.

Chọn A
Thể tích của 1 mol Fe là: 55 , 847 : 7 , 87 = 7 , 096 c m 3
Thể tích của một nguyên tử Fe là:
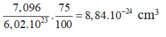
Bán kính gần đúng của nguyên tử Fe là:
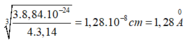

Đáp án C
Giả sử trong 1 mol Fe.
Thể tích thực của Fe là:

Thể tích 1 nguyên tử Fe là:
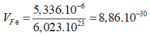
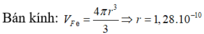


Khối lượng riêng của Cr là 7,2 g/cm3;
nghĩa là 7,2 gam Cr ↔ 7,2 ÷ 52 × 6,023 × 1023 hạt nguyên tử Cr chiếm thể tích là 1cm3 = 10-6 m3.
Lại để ý: mỗi nguyên tử chỉ chiếm 68% thể tích tinh thể (còn lại là rỗng),
nghĩa là thể tích thực của mỗi nguyên tử Crom là:
V1 nguyên tử = 10-6 × 0,68 ÷ (7,2 ÷ 52 × 6,023 × 1023)) = 4 ÷ 3πr3.
Bấm fx CASIO có ngay r = 1,25 × 10-10 m = 0,125 nm.
ta chọn đáp án B.