Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: Mg(OH)2 =(nhiệt)==> MgO + H2O
x x
4Fe(OH)2 + O2 =(nhiệt)==> 2Fe2O3 + 4H2O
y 0,25y 0,5y
Gọi số mol của Mg(OH)2, Fe(OH)2 lần lượt là x, y
Lập các số mol theo phương trình và theo đề ra ta có hệ phương trình sau:
\(\begin{cases}58x+90y=1,32a\\40x+80y=a\end{cases}\)
Giải phương trình ta đc \(\begin{cases}x=0,015a\\y=0,005a\end{cases}\)
=> %mMgO =\(\frac{0,015a.40}{a}\) x 100% = 60%
=>%mFe2O3 = 100% - 60% = 40%
Chúc bạn hoc tốt!!!

PTHH:
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
x....................x
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
y...................................0,5y
Gọi số mol Mg(OH)2, Fe(OH)2 lần lượt là x, y (mol)
Theo đề ra, ta có:
\(\begin{cases}58x+90y=1,32a\\40x+80y=a\end{cases}\)
\(\Rightarrow\begin{cases}x=0,015a\\y=0,005a\end{cases}\)
=> mMgO = 0,015a x 40 = 0,6a (gam)
=> %mMgO = \(\frac{0,6a}{a}.100\%=60\%\)
=> %mFe2O3 = 100% - 60% = 40%
PTHH: Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Gọi số mol của Mg(OH)2 là x , số mol của Fe(OH)2 là y => Số mol của MgO là a , số mol của FeO là b
Ta có hệ phương trình sau:
- 58x + 90y = 1,32a (1)
- 40x + 72y = a (2)
Nhân phương trình (2) với 1,32 ta có :
52,8x + 95,04y = 1,32a (3)
Vì phương trình (3) và phương trình (1) đều bằng 1,32a
=> 58x + 90y = 52,8x + 95,04y
=> x = 0,97y
%MgO trong hỗn hợp oxit là:
40x/40x+72y.100%=40.0,97y/40.0,97y+72y.100%=35,02%.40x/40x+72y.100%=40.0,97y/40.0,97y+72y.100%=35,02%
%FeO trong hỗn hợp oxit là:
100% - 35,02% = 64,98%

\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
Chất rắn tan dần , tạo dung dịch màu vàng nâu lẫn lục nhạt.
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\)
Xuất hiện kết tủa nâu đỏ và một phần trắng xanh hóa nâu đỏ trong không khí.
\(4Fe\left(OH\right)_2+O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3+4H_2O\)
\(2Fe\left(OH\right)_3\underrightarrow{^{^{t^0}}}Fe_2O_3+3H_2O\)
PTHH: 3 Fe + 2 O2 -to-> Fe3O4
Fe3O4 + 8 HCl -> 2 FeCl3 + FeCl2 +4 H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 + 3 NaOH -> Fe(OH)3 + 3 NaCl
4 Fe(OH)2 + O2 + 2 H2O -to-> 4 Fe(OH)3
2 Fe(OH)3 -to-> Fe2O3 + 3 H2O
Hiện tượng: Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hoá học là Fe3O4 thường được gọi là oxit sắt từ. Sau đó khi cho vào dd HCl dư, thì tạo hỗn hợp dung dịch có màu nâu đỏ và màu trắng xanh. Sau khi đem tác dụng NaOH tạo các kết tủa nâu đỏ, trắng xanh. Cuối cùng cho nung ở không khí tại nhiệt độ cao sẽ thu được chất rắn nâu đỏ đó là Fe2O3.
Giải thích: Oxi đã OXH sắt thành oxit sắt từ -> HCl đã tác dụng với Fe3O4 tạo FeCl2 và FeCl3 -> P.ứ giữa 2 muối sắt clorua với NaOH tạo kết tủa -> 2 kết tủa nung ngoài không khí, vì Fe(OH)2 bị oxh thành sắt 3 nên cùng nung tạo rắn đỏ nâu.

Đáp án B
Nung nóng Fe ( OH ) 3 đến khối lượng không thay đổi → Fe2O3

a) PTHH: \(3NaOH+FeCl_3\rightarrow3NaCl+Fe\left(OH\right)_3\downarrow\)
b) Ta có: \(\left\{{}\begin{matrix}n_{NaOH}=0,5\cdot0,1=0,05\left(mol\right)\\n_{FeCl_3}=0,2\cdot0,2=0,04\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{3}< \dfrac{0,04}{1}\) \(\Rightarrow\) NaOH p/ứ hết, FeCl3 còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{NaCl}=0,05\left(mol\right)\\n_{FeCl_3\left(dư\right)}=\dfrac{7}{300}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{NaCl}=0,05\cdot58,5=2,925\left(g\right)\\m_{FeCl_3\left(dư\right)}=\dfrac{7}{300}\cdot162,5\approx3,8\left(g\right)\end{matrix}\right.\)
c) PTHH: \(2Fe\left(OH\right)_3\xrightarrow[]{t^o}Fe_2O_3+3H_2O\)
Ta có: \(n_{Fe\left(OH\right)_3}=\dfrac{1}{60}\left(mol\right)\) \(\Rightarrow n_{H_2O}=\dfrac{1}{40}\left(mol\right)\) \(\Rightarrow m_{H_2O}=\dfrac{1}{40}\cdot18=0,45\left(g\right)\)

PTHH: Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Gọi số mol của Mg(OH)2 là x , số mol của Fe(OH)2 là y => Số mol của MgO là a , số mol của FeO là b
Ta có hệ phương trình sau:
- 58x + 90y = 1,32a (1)
- 40x + 72y = a (2)
Nhân phương trình (2) với 1,32 ta có :
52,8x + 95,04y = 1,32a (3)
Vì phương trình (3) và phương trình (1) đều bằng 1,32a
=> 58x + 90y = 52,8x + 95,04y
=> x = 0,97y
%MgO trong hỗn hợp oxit là:
\( {40x\ \over40x + 72y}\) . 100% = \( {40.0,97y \over 40.0,97y+72y}\) .100% = 35,02%
%FeO trong hỗn hợp oxit là:
100% - 35,02% = 64,98%


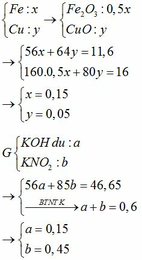
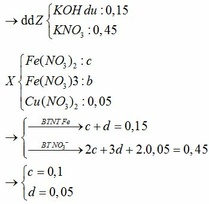

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%
PTHH: 2Fe(OH)3 ---to---> Fe2O3 + 3H2O
Vậy chất rắn thu được là Fe2O3