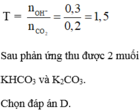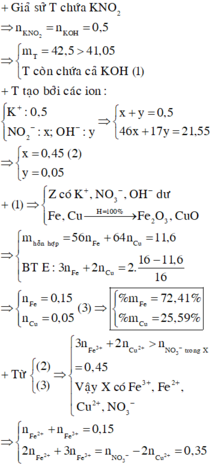Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
Gọi CT chung của 2 muối cacbonat kim loại hóa trị II là RCO3
RCO3 → (đk :t0) RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có :
m CO2 = m RCO3 - mRO = 13,4 – 6,8 = 6,6 g
=> n CO2 = 0,15 mol
Ta có :
n NaOH = 0,075 mol
=> k = n NaOH / nCO2 = 0,075 / 0,15 = 0,5 < 1
=> Tạo muối NaHCO3 và CO2 dư
CO2 + NaOH → NaHCO3
0,075 0,075
=> mmuối = 0,075. 84 = 6,3 g

mCO2 = 13.4 - 6.8 = 6.6 > nCO2 = 0.15mol.
nNaOH = 0.075 mol > nCO2 = 2nNaOH > muối NaHCO3 với m = 6.3g

Đáp án D
Nhận xét: nếu 1 mol NaOH cho vào X mà phản ứng hết
=> chỉ tính riêng 1 mol N a N O 3 trong Y cô cạn cho 1 mol N a N O 2 đã nặng 69 g a m > 67 , 55 g a m rồi
⇒ chứng tỏ Y gồm x mol N a N O 3 +ymol NaOH dư.
⇒ có hệ x+y=1 mol và 69x 40y = 67,55 gam
![]()
=>bảo toàn điện tích có n H + c o n d u = 0 , 1 m o l
Bảo toàn nguyên tố H có n H 2 O = 0 , 45 m o l
⇒ n O s p k = 0 , 3 m o l (theo bảo toàn O ).
Tiếp tục bảo toàn nguyên tố N có n N s p k = 0 , 2 m o l
⇒ m s p k = m N + m O = 7 , 6 g a m

Đáp án C
Khi nung đến khối lượng không đổi ta có:
Ba(HCO3)2 → BaO || NaHCO3 → Na2CO3.
Đặt nBa(HCO3)2 = a và nNaHCO3 = b ta có:
PT theo m hỗn hợp: 259a + 84b = 30,52 (1).
PT theo m rắn sau khi nung: 153a + 53b = 18,84 (2)
+ Giải hệ (1) và (2) ta có a = 0,04 và b = 0,24.
● Bảo toàn cacbon ⇒ Y chứa 0,2 mol CO2 và hơi nước.
+ Hòa tan X vào H2O ta có:
BaO → H 2 O nBa(OH)2 = 0,04 mol
Nhận thấy nCO2 cho vào < nOH– ⇒ CO2 sẽ bị hấp thụ để tạo muối HCO3–.
Ta có nBaCO3 = 0,04 mol ||⇒ Bảo toàn khối lượng ta có:
mChất tan trong T = 0,04×171 + 0,12×106 + 0,1×44 + (0,1–0,04×2)×18 – 0,04×197 = 16,44 gam


Do KOH dư ⇒ kết tủa hết ion kim loại ⇒ nung T thì rắn gồm Fe2O3 và CuO.
⇒ mrắn = 41,05 = 0,5a × 160 + 80b. Giải hệ có: a = 0,15 mol; b = 0,05 mol.
Quy hỗn hợp B về N và O. Bảo toàn nguyên tố nitơ có nN spk = 0,7 – 0,45 = 0,25 mol.

⇒ bảo toàn nguyên tố oxi có nO sk = 0,7 × 3 – 0,45 × 3 – 0,35 = 0,4 mol.
⇒ BTKL mdung dịch sau phản ứng = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2 gam.
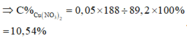
Đáp án C

Đáp án B
n H N O 3 = 0,96 mol và n N a O H = 0,4 mol, n K O H = 0,2
đặt n F e = x mol và n C u = y mol
Bảo toàn nguyên tố có n F e 2 O 3 = ½ . n F e = ½ .x
n C u O = n C u = y
Ta có hệ phương trình sau 56x + 64 y = 14,8 gam và 80x + 80y = 20
→ x = 0,15 mol và y = 0,1 mol
Nếu dung dịch Z chỉ chứa 2 muối N a N O 3 và K N O 3 thì khi đun nóng thu được K N O 2 và N a N O 2
Bảo toàn nguyên tố có n N a N O 2 = n N a O H = 0,4 và n K O H = 0,2 = n K N O 2
→ mrắn = 0,4.69 +0,2. 85 = 44,6 gam > 42,86 nên Z còn chứa cả NaOH và KOH
Z chứa : N a + : 0,4 mol; K + : 0,2 mol; OH- : a mol và N O 3 - : b mol
Bảo toàn điện tích có 0,4 + 0,2 = a + b (*)
Đun nóng Z có 0,4 mol Na ; K + : 0 , 2 m o l ; O H - : a m o l v à N O 2 - : b m o l
→ 17a + 46b + 0,2.39 + 0,4.23 = 42,86 (**)
Từ (*) và (**) → a = 0,06 và b = 0,54
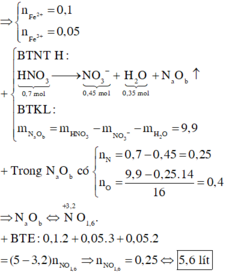
→ dd X chứa F e 2 + : c m o l ; F e 3 + : d m o l v à C u 2 + : 0 , 1 m o l ; N O 3 - : 0 , 54 m o l (cùng bằng lượng NO3- trong Z)
Bảo toàn điện tích có 2c + 3d + 0,1.2 = 0,54 (***)
Bảo toàn Fe có c + d =0,15 (****)
Từ (***) và (****) → c = 0,11 và d =0,04 mol
Bảo toàn nguyên tố có n N (sp khử) = n H N O 3 – n N O 3 (Y) = 0,96 – 0,54 =0,42 mol
Quy đổi khí sản phẩm khử là N : 0,42 mol và O : e mol
Bảo toàn e có 2 n F e ( 2 + ) + 3 n F e ( 3 + ) + 2 n C u ( 2 + ) - 2 n O = 5 n N
→ 5.0,42 = 2.0,11 +3.0,04 + 0,1.2 +2e
→ e = 0,78 mol
Bảo toàn khối lượng mdd X = m K L + m H N O 3 – m N – m O
= 14,8 + 126 – 0,42.14 – 0,78.16 =122,44 g
Nồng độ % của F e N O 3 3 là := 7,9%