Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Axit sunfuric đặc giống tính chất axit sunfuric loãng ở chỗ :
- Đều hòa tan oxit kim loại(có hóa trị cao nhất) thành muối tương ứng và nước
$Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O$
- Đều phản ứng với dung dịch kiềm,bazo mà gốc kim loại có hóa trị cao nhất,...
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
Khác nhau ở chỗ :
- hòa tan 1 số kim loại :
Axit sunfuric loãng không tác dụng với Cu
Axit sunfuric đặc có tác dụng với Cu :
$Cu + 2H_2SO_{4_{đặc}} \xrightarrow{t^o} CuSO_4 + SO_2 + 2H_2O$
- hòa tan oxit bazo :
$FeO + H_2SO_4 \to FeSO_4 + H_2O$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
Axit sunfuric đặc cũng có một số tính chất giống của axit sunfuric loãng là gì?
+ Làm quỳ hóa đỏ
+ Tác dụng với kim loại
+ Tác dụng với bazo
+ Tác dụng với oxit bazo
+ Tác dụng với muối
Ví dụ :
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Tính chất riêng :
Axit sunfuric đặc có đặc tính háo nước và tỏa nhiều nhiệt
C12H22O11 + 24H2SO4 → 12CO2 + 24SO2 + 35H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch H2SO4 đặc, nguội
Axit sunfuric đặc tác dụng với phi kim
C +2H2SO4 đặc nóng → CO2 +2SO2 + 2H2O
Axit sunfuric đặc tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O

Các phát biểu không đúng: 2, 4, 6
2) Metan là chất khí, không màu, không mùi, nặng hơn không khí => Sai, khí metan nhẹ hơn không khí.
4) Hỗn hợp giữa Metan và Clo là hỗn hợp nổ => Sai.
6) Metan tác dụng với Clo ở điều kiện thường => Sai, phải có chiếu sáng thì phản ứng mới xảy ra
Đáp án: C

Chọn C
Các oxit bazơ của kim loại kiềm và kiềm thổ (trừ BeO, MgO) tác dụng được với nước ở điều kiện thường.
![]()

Bảo toàn e cho toàn quá trình.
Chất khử là Al,chất oxh là N+5
đặt số mol NO2l= là x, NÓ là y.
Ta có
-theo bài ra : x+y=0,04
-theo bảo toàn e : x+3y=(0,54/27)*3=0,06
giải ra đươc x=0,03 y=0,01
M hh khí = (0,03*46+0,01*30)/0,04=42
tỉ khối = 21

Phản ứng trao đổi là một loại phản ứng hoá học, trong đó, các chất trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi chỉ số oxi hóa. Từ sự trao đổi này, chúng hình thành nên những chất mới của phương trình phản ứng
* Ví dụ:
HCl + NaOH → NaCl + H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
* Điều kiện:
- Các chất tạo thành phải có ít nhất một chất kết tủa hoặc dễ bay hơi hay dễ phân huỷ, hoặc yếu hơn so với chất tham gia (đối với axít)
- Muối và bazơ (ban đầu) phải tan.
Một trong 2 sản phẩm có kết tủa
- Hai muối tham gia phản ứng đều tan.
- Sản phẩm có chất kết tủa hoặc có chất khí bay hơi
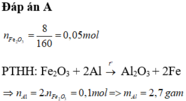



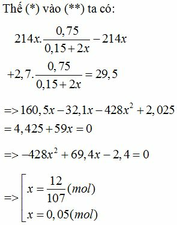
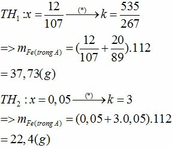
nhôm ko pứ với nước ở đk thường