Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
(1) 2NaOH + Ca(HCO3)2→ CaCO3↓ + Na2CO3 +2H2O
(2) NaAlO2 + HCl + H2O → Al(OH)3 + NH4Cl
Al(OH)3 + 3HCl → AlCl3 + 3 H2O
(3) Không xảy ra phản ứng
(4) 3NH3 + 3H2O + AlCl3→Al(OH)3↓ +3NH4Cl
(5) CO2 + 2H2O + NaAlO2→ NaHCO3 + Al(OH)3↓
(6) 3C2H4 + 2KMnO4 + 4H2O → 3 C2H4(OH)2 + 2MnO2 + 2KOH
=> Đáp án D

\(n_{OH^-}=0,2.1+0,2.1.2=0,6\left(mol\right)\)
\(n_{H^+}=V.2+V.1.2=4V\left(mol\right)\)
H+ + OH- --------> H2O (1)
Vì dung dịch A được trung hòa bởi 200 ml dd HNO3 1M
=>Dung dịch A có OH- dư sau phản ứng
\(n_{H^+}=0,2.1=0,2\left(mol\right)\)
H+ + OH- dư --------> H2O
=> \(n_{OH^-\left(dư\right)}=n_{H^+\left(củaHNO3\right)}=0,2\left(mol\right)\)
=> \(n_{OH^-\left(pứ\right)}=0,6-0,2=0,4\left(mol\right)\)
Từ (1) => \(n_{H^+}=n_{OH^-\left(pứ\right)}=0,4\left(mol\right)\)
=> 4V=0,4
=> V= 0,1 (lít)

a) Gọi V là thể tích HCl (lít)
HCl -> H+ + Cl-
0,1V -> 0,1V 0,1V mol
[H+] = 0,1V / V = 0,1 M => pH = -log(0,1) = 1
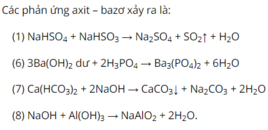
Trích mẫu thử
Cho quỳ tím vào mẫu thử :
- mẫu thử làm quỳ tím hóa đỏ là $HCl,HNO_3$ - nhóm 1
- mẫu thử làm quỳ tím hóa xanh là $Ca(OH)_2,NaOH,NH_3$ - nhóm 2
Cho dung dịch$ AgNO_3$ vào nhóm 1 :
- mẫu thử tạo kết tủa trắng là HCl
$HCl + AgNO_3 \to AgCl + HNO_3$
- mẫu thử không hiện tượng là $HNO_3$
Sục khí $CO_2$ vào nhóm 2 :
- mẫu thử tạo vẩn đục trắng là $Ca(OH)_2$
$Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O$
Cho $Al(OH)_3$ vào hai mẫu thử còn :
- mẫu thử nào làm $Al(OH)_3$ tan là $NaOH$
$Al(OH)_3 + NaOH \to NaAlO_2 + 2H_2O$
- mẫu thử nào không tan là $NH_3$