Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nhận biết các dung dịch sau bằng phương pháp hoá học
FeCl3, Fe2(SO4)3, Fe(NO3)3, KOH
ta nhúm quỳ tím
- quỳ chuyển xanh là KOH
- quỳ ko chuyển màu là FeCl3, Fe2(SO4)3, Fe(NO3)3
sau đó ta nhỏ BaCl 2
- có kết tủa trắng là Fe2(SO4)3
- còn lại là Fecl3, Fe(NO3)3
Ta nhỏ thêm AgNO3 vào
- cũng xuất hiện kết tủa trắng là FeCl3
- còn lại là Fe(NO3)3
Fe2(SO4)3+3BaCl2->3BaSO4+2FeCl3
FeCl3+3AgNO3->3AgCl+Fe(NO3)3

Dùng dung dịch Ba(OH)2
- Không hiện tượng ➞ NaNO3
- Xuất hiện khí mùi khai và kết tủa trắng ➞ (NH4)2SO4
- Chỉ xuất hiện khí mùi khai ➞ NH4Cl
- Xuất hiện kết tủa trắng không tan trong Ba(OH)2 dư (Mg(OH)2, BaSO4) ➞ MgSO4
- Xuất hiện kết tủa trắng tan một phần trong Ba(OH)2 dư (Al(OH)3, BaSO4) ➞ Al2(SO4)3
- Xuất hiện hỗn hợp kết tủa trắng và trắng xanh (BaSO4, Fe(OH)2) ➞ FeSO4
- Xuất hiện hỗn hợp kết tủa trắng và nâu đỏ (BaSO4, Fe(OH)3) ➞ Fe2(SO4)3
Cho từ từ đến dư Ba(OH)2 vào các dung dịch:
- Al2(SO4)3 tạo kết tủa rồi tan 1 phần:
Al2(SO4)3 + 3Ba(OH)2 \(\rightarrow\) 2Al(OH)3\(\downarrow\) + 3BaSO4\(\downarrow\)
2Al(OH)3 + Ba(OH)2 \(\rightarrow\) Ba(AlO2)2 + 4H2O
- MgSO4 tạo kết tủa trắng không tan:
MgSO4 + Ba(OH)2 \(\rightarrow\) BaSO4\(\downarrow\) + Mg(OH)2\(\downarrow\)
- Fe2(SO4)3 tạo kết tủa màu nâu đỏ:
Fe2(SO4)3 + 3Ba(OH)2 \(\rightarrow\) 3BaSO4\(\downarrow\) + 2Fe(OH)3\(\downarrow\)
- FeSO4 tạo kết tủa trắng xanh hóa nâu trong không khí:
FeSO4 + Ba(OH)2 \(\rightarrow\) BaSO4\(\downarrow\) + Fe(OH)2\(\downarrow\)
4Fe(OH)2 + O2 + 2H2O \(\rightarrow\) 4Fe(OH)3\(\downarrow\)
- (NH4)2SO4 vừa có kết tủa trắng, vừa có khí mùi khai bay ra:
(NH4)2SO4 + Ba(OH)2 \(\rightarrow\) BaSO4\(\downarrow\) + 2NH3\(\uparrow\) + 2H2O
- NH4Cl có khí mùi khai bay ra:
2NH4Cl + Ba(OH)2 \(\rightarrow\) BaCl2 + 2NH3\(\uparrow\) + 2H2O
- Còn lại NaNO3 không có hiện tượng gì.

Trích các mẫu thử rồi đánh dấu.
- Cho quỳ tím vào các mẫu thử:
Mẫu thử làm quỳ tím hóa đỏ là \(\left(NH_4\right)_2SO_4,Fe_2\left(SO_4\right)_3\).
Mẫu thử làm quỳ tím hóa xanh là \(Na_2CO_3,Ba\left(OH\right)_2\).
Mẫu thử không làm đổi màu quỳ tím là \(KNO_3,NaCl\).
- Cho dung dịch NaOH dư vào hai mẫu thử \(\left(NH_4\right)_2SO_4,Fe_2\left(SO_4\right)_3\).
Mẫu thử phản ứng xuất hiện kết tủa nâu đỏ là \(Fe_2\left(SO_4\right)_3\).
Mẫu thử có khí mùi khai thoát ra là \(\left(NH_4\right)_2SO_4\).
PTHH:
\(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow2Fe\left(OH\right)_3\downarrow+3Na_2SO_4\)
\(\left(NH_4\right)_2SO_4+2NaOH\rightarrow2NH_3\uparrow+Na_2SO_4+2H_2O\)
- Cho dung dịch \(H_2SO_4\) loãng dư vào hai mẫu thử \(Na_2CO_3,Ba\left(OH\right)_2\).
Mẫu thử làm xuất hiện kết tủa trắng là \(Ba\left(OH\right)_2\).
Mẫu thử làm xuất hiện khí thoát ra là \(Na_2CO_3\).
PTHH:
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2H_2O\)
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2\uparrow+H_2O\)
- Cho dung dịch \(AgNO_3\) dư vào hai mẫu thử \(KNO_3,NaCl\).
Mẫu thử làm xuất hiện kết tủa trắng là \(NaCl\).
Mẫu thử không xảy hiện tượng là \(KNO_3\).
PTHH:
\(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)

Đáp án D
• 0,42 mol NaOH + 0,02 mol Fe2(SO4)3; 0,04 mol Al2(SO4)3 → 500ml X + ↓
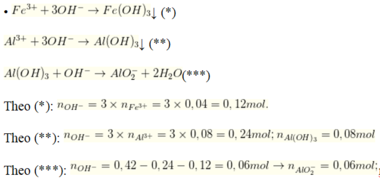
nAl(OH)3 = 0,08 - 0,06 = 0,02 mol
Vậy sau phản ứng 500ml dung dịch X gồm 0,06 mol Na[Al(OH)4]; 0,18 mol Na2SO4
→ CM các chất trong X là CMNa2SO4 = 0,06 : 0,5 = 0,12 M;
CMNa[Al(OH)4] = 0,18 : 0,5 = 0,36 M

a, - Trích mẫu thử.
- Cho từng mẫu thử pư với dd Ba(OH)2
+ Có khí mùi khai: NH4Cl
PT: \(Ba\left(OH\right)_2+2NH_4Cl\rightarrow BaCl_2+2NH_3+2H_2O\)
+ Có tủa trắng và khí mùi khai: (NH4)2SO4
PT: \(\left(NH_4\right)_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2NH_3+2H_2O\)
+ Có tủa trắng: Na2SO4
PT: \(Na_2SO_4+Ba\left(OH\right)_2\rightarrow2NaOH+BaSO_4\)
+ Không hiện tượng: NaCl.
- Dán nhãn.
b, - Trích mẫu thử.
- Cho từng mẫu thử pư với dd NaOH
+ Có tủa xanh: CuSO4
PT: \(CuSO_4+2NaOH\rightarrow Na_2SO_4+Cu\left(OH\right)_2\)
+ Không hiện tượng: K2SO4, KNO3, Ba(NO3)2 (1)
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: K2SO4
PT: \(BaCl_2+K_2SO_4\rightarrow2KCl+BaSO_4\)
+ Không hiện tượng: KNO3, Ba(NO3)2 (2)
- Cho mẫu thử nhóm (2) pư với dd K2SO4
+ Có tủa trắng: Ba(NO3)2
PT: \(K_2SO_4+Ba\left(NO_3\right)_2\rightarrow2KNO_3+BaSO_4\)
+ Không hiện tượng: KNO3
- Dán nhãn.


Cho một ít dung dịch NaOH dư vào từng mẫu một, nếu:
+ Kết tủa xanh: CuSO4
\(CuSO_4+NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
+ Kết tủa trắng: MgSO4
\(MgSO_4+NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
+ Kết tủa keo trắng rồi tan dần: Al2(SO4)3
\(Al_2\left(SO_4\right)_3+NaOH\rightarrow Al\left(OH\right)_3+Na_2SO_4\)
\(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
+Kết tủa trắng xanh: FeSO4
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
+Kết tủa màu nâu đỏ: Fe2(SO4)3
\(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow2Fe\left(OH\right)_3+3Na_2SO_4\)