Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
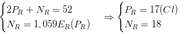
D sai vì ở trạng thái cơ bản Cl chỉ có 1 e độc thân
Chọn D

Đáp án D.
Tổng số các loại hạt proton, nơtron và electron của R là 52
p + n + e = 52 => 2p + n = 52 (1)
Tổng số hạt không mang điện gấp 1,059 số hạt mang điện âm
n = 1,059.e hay n -1,059p = 0 (2)
Từ (1), (2) ta có p = e =17 , n =18
Số khối của R = 35.

Đáp án D.
Tổng số các loại hạt proton, nơtron và electron của R là 52
P + n + e = 52 2p + n = 52 (1)
Tổng số hạt không mang điện gấp 1,059 số hạt mang điện âm
n = 1,059.e hay n -1,059p = 0 (2)
Từ (1), (2) ta có p = e =17 , n =18
R là Clo, thuộc nhóm VIIA. Số oxi hóa cao nhất là +7

Đáp án C
Giả sử số hiệu nguyên tử, sơ nơtron trong nguyên tử nguyên tố Y lần lượt là Z, N.
Ta có hpt:
2
Z
+
N
=
52
N
=
1
,
059
Z
→
Z
=
17
N
=
18
Cấu hình electron của Y: 1s22s22p63s23p5. X có 7 electron lớp ngoài cùng → Y là phi kim.
Y có điện tích hạt nhân là 17+.
Ở trạng thái cơ bản, Y có 1 electron độc thân.
Y có số khối bằng: A = Z + N = 17 + 18 = 35.
→ Chọn C

Đáp án B
Gọi Z là số proton của Y => Số electron của Y là Z
Gọi N là số nơtron của Y
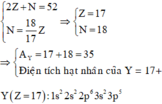
=>Y có 7e lớp ngoài cùng => Y là nguyên tố phi kim.

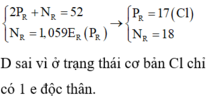

Giả sử số hiệu nguyên tử và số nơtron trong nguyên tử R lần lượt là Z, N.
Ta có hpt:
R có 17 electron, 17 proton và 18 nơtron
Số hạt mang điện nhiều hơn số hạt không mang điện là 2Z - N = 2 x 17 - 18 = 16.
R có số khối là A = 17 + 18 = 35.
Điện tích hạt nhân của R là 17+.
→ Chọn D.