Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Y công thức Oxit cao nhất là YO3 Y có hóa trị VI
Y thuộc nhóm VIA
Mặt khác Y thuộc chu kì 3 Y là S Hợp chất M là MS
M chiếm 63,64% khối lượng:
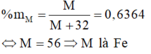

Đáp án C
Y công thức Oxit cao nhất là YO3 ⇒ Y có hóa trị VI
⇒ Y thuộc nhóm VIA
Mặt khác Y thuộc chu kì 3 ⇒ Y là S ⇒ Hợp chất M là MS
M chiếm 63,64% khối lượng:
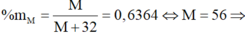 M là Fe
M là Fe

*Xác định Y:
Y thuộc chu kì 2 => Y có 2 lớp e
Công thức oxit cao nhất của Y là YO2
=> Y có hóa trị IV
=> Y thuộc nhóm IVA
=> Y có 4e lớp ngoài cùng
=> Cấu hình e của Y: 1s22s22p2
=> Y là Cacbon
*Xác định M:
Hợp chất MC2
\(\%m_C=\dfrac{2.12}{M+2.12}.100=37,5\%\)
=> M=40 (Ca)
Vậy M là Ca

M chiếm 46,67% về khối lượng:

Quan sát – phân tích: Hệ 5 ẩn gồm 4 phương trình không thể giải thông thường để tìm nghiện vì ta cần phải rút gọn nghiệm: Phương trình (2) chứa ẩn ZM và x. ZA từ phương trình (1); (3); (4) ta có thể đưa về 1 phương trình chứa 2 ẩn ZM và x
Z A → Đưa về hệ phương trình 2 ẩn.
Ta đưa được về hệ sau
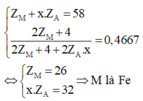
M là Fe nên x sẽ nhận giá trị từ 1 đến 3.
Từ x.ZA = 32 ta có các giá trị của ZA

Vậy H là FeS2
Đáp án A.

CT oxit cao nhất là YO3.
⇒ Y có hóa trị cao nhất với oxy = 6
Vậy Y ở nhóm VIA, chu kỳ 3.
Cấu hình e-: 1s2 2s2 2p6 3s2 3p4.
ZY là 16 (S) ⇒ MY : MS
Mặt khác:
Nguyên tố Y là phy kim thuộc chu kì 3 , có công thức oxit cao nhất là YO3 \(\Rightarrow Y\)là \(S\)
Nguyên tố S tạo bởi 2 kim loại M hợp chất có CT MS
\(\%M=\frac{M_M}{M_M+32}=63,64\%\Rightarrow M_M=56\Rightarrow M\)là \(Fe\)

Câu 1 : \(\%_H=\frac{3}{R+3}\cdot100=17.65\)
\(\Rightarrow R=14\)
Vậy R là N(Nitơ)
Câu 2:
Nguyên tố X có hóa trị cao nhất với Oxi gấp 3 lần so vs hc của Hidro nên X thuộc nhóm VIA
hóa trị cao nhất vs Oxi là XO3
mà tỉ khối hơi so với Nitơ là 2.875 tức MXO3 =80.5
MX=32.5
Vậy X là S(Lưu huỳnh)
1.
\(\text{% R= 100-% H= 100-17,65 = 82.35 %}\)
Ta có :
\(\frac{MR}{\%R}=\frac{MH}{\%H}\Rightarrow\frac{MR}{82,35}=\frac{3}{17,65}\)
\(\Rightarrow MR=13,99\approx14\left(đvC\right)\)
\(\rightarrow\)R là nitơ (NH3)
2.
Hóa trị của X vs oxi, hidro lần lượt là x,y
\(\Rightarrow\left\{{}\begin{matrix}\text{x + y = 8}\\\text{x =3y}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{x = 6}\\\text{y = 2}\end{matrix}\right.\)
Hợp chất của X vs oxi là XO3
\(\rightarrow\text{M(XO3) = 2,857.28=80}\)
\(\rightarrow\text{X = 32 }\)
\(\rightarrow\)Lưu huỳnh(S)
3.
Hợp chất của R vs Oxi là R2O5
\(\%R=\frac{2R}{\left(2R+16.5\right)}\text{= 0,4366}\)
\(\rightarrow R=31\left(\frac{g}{mol}\right)\)
\(\rightarrow\) R là Photpho
4.
Y tạo vs Oxi hợp chất YO3
\(\rightarrow\) Y tạo vs H hợp chất H2Y
Và Y ở chu kì 3\(\rightarrow\) Y là S
\(\%M=\frac{M}{\left(M+2.32\right)}\text{ = 0,4667}\)
\(\rightarrow\text{M = 56}\)
\(\Rightarrow\)M là Sắt(Fe)
Lần sau bn đăng tách câu hỏi ra cho dễ nhìn nhé

Đáp án D
Trong hợp chất MAx, M chiếm 46,67% về khối lượng nên :
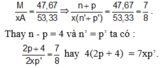
Tổng số proton trong MAx là 58 nên: p + xp’ = 58. Từ đây tìm được: p = 26 và xp’ = 32.
Do A là phi kim ở chu kì 3 nên 15 ≤ p’ ≤ 17. Vậy x = 2 và p’ = 16 thỏa mãn.
Vậy M là Fe và A là S; công thức của MAx là FeS2.

B
Công thức hợp chất khí với H của R là R H 4 → công thức oxit cao nhất của R là R O 2 .
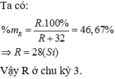
Đáp án đúng : D