Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)

2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag↓
AgNO3 là chất oxi hóa, Cu là chất khử.
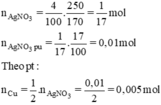
Áp dụng tăng giảm khối lượng

\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A

2Al + 2H2O + 2NaOH -> 2NaAlO2 + 3H2
0,1 mol <- 0,15mol
Fe2O3 + NaOH -> Fe(OH)3 + Na2O
nH2= 3,36:22,4 = 0,15 mol
mAl = 0,1*27 = 2,7 g
=> mFe2O3 = 20-2,7 = 17,3 g
nH2= 0,15 mol
2Al + 2NaOH + 2H2O→ 2NaAlO2 + 3H2↑
0,1 mol 0,15 mol
→mAl= 0,1x27= 2,7 (g) →mFe2O3= 20-2,7= 17,3 (g)

Đáp án B.
Ta có nNO = 4,48 / 22,4 = 0,2 mol.
3M + 4HNO3 → 3M(NO3)n + nNO + 2H2O.
nM = 0,6 / n.
MM = 32n.
=> n=2 => M = Cu.

Khối lượng của AgNOg trong dung dịch là:
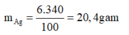
Phương trình phản ứng xảy ra:
![]()
Cứ 1 mol Cu phản ứng với 2 mol AgNO3, sinh ra 1 mol Cu(NO3)2 và 2 mol Ag, khối lượng kim loại tăng
![]()
Khối lượng AgNO3 đã tham gia phản ứng:
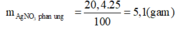
Từ (1)=> Số mol Cu đã phản ứng:
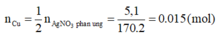
=> Khối lượng của vật sau phản ứng: m = 15 + 152.0,015 = 17,28 (gam).
Đáp án B.

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g