Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng vật sau phản ứng = 10 + 0,01 x 108 – 0,005 x 64 = 10,76 g

2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Phương trình ion thu gọn: Cu + 2Ag+ → Cu2+ + 2Ag↓
AgNO3 là chất oxi hóa, Cu là chất khử.
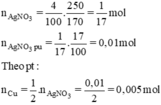
Áp dụng tăng giảm khối lượng

\(n_{AgNO_3}=\dfrac{250.4}{100.170}=\dfrac{1}{17}\left(mol\right)\)
=> \(n_{AgNO_3\left(pư\right)}=\dfrac{1}{17}.17\%=0,01\left(mol\right)\)
PTHH: Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
____0,005<--0,01--------------------->0,01
=> m = 12 - 0,005.64 + 0,01.108 = 12,76(g)
=> A

Điều kiện cần và đủ là:
- Các điện cực phải khác chất nhau: có thể là cặp kim loại khác nhau, cặp kim loại - phi kim (C), cặp kim loại - hợp chất hóa học ( xêmentit ). Trong đó kim loại có tính khử mạnh hơn sẽ là cực âm. Như vậy kim loại nguyên chất khó bị ăn mòn.
- Các điện cực phải tiếp xúc với nhau ( hoặc trực tiếp hoặc gián tiếp qua dây dẫn )
- Các điện cực cùng tiếp xúc với một dung dịch điện li
(a) Ngâm lá đồng trong dung dịch AgNO3.
(d) Ngâm lá sắt được cuốn dây đồng trong dung dịch HCl.
(e) Để một vật bằng gang ngoài không khí ẩm.
Đáp án D

Đáp án C.
- Ngâm một lá đồng trong dung dịch AgNO3; ăn mòn điện hóa
- Ngâm một lá kẽm trong dung dịch HCl loãng; ăn mòn hóa học
- Ngâm một lá nhôm trong dung dịch NaOH; ăn mòn hóa học
- Ngâm ngập một đinh sắt được quấn một đoạn dây đồng trong dung dịch NaCl. ăn mòn điện hóa
- Để một vật bằng gang ngoài không khí ẩm; ăn mòn điện hóa
- Ngâm một miếng đồng vào dung dịch Fe2(SO4)3; ăn mòn hóa học
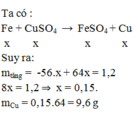
PTHH: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
a) Ta có: \(n_{AgNO_3}=\dfrac{300\cdot5\%}{170}=\dfrac{3}{34}\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Ag}=\dfrac{3}{34}\left(mol\right)\\n_{Cu}=\dfrac{3}{68}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Ag}=\dfrac{3}{34}\cdot108\approx9,53\left(g\right)\\m_{Cu}=\dfrac{3}{68}\cdot64\approx2,82\left(g\right)\end{matrix}\right.\)
b) Coi như p/ứ vừa đủ
Theo PTHH: \(n_{Cu\left(NO_3\right)_2}=n_{Cu}=\dfrac{3}{68}\left(mol\right)\) \(\Rightarrow m_{Cu\left(NO_3\right)_2}=\dfrac{3}{68}\cdot188\approx8,29\left(g\right)\)
Mặt khác: \(m_{dd\left(sau.p/ứ\right)}=m_{Cu}+m_{ddAgNO_3}-m_{Ag}=293,29\left(g\right)\)
\(\Rightarrow C\%_{Cu\left(NO_3\right)_2}=\dfrac{8,29}{293,29}\cdot100\%\approx3,46\%\)
Anh ơi làm sao để ra 3/34 và 3/68 vậy ạ