Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho dung dịch NaOH dư vào hỗn hợp 3 kim loại thu được hai phần.
- Phần dung dịch là NaAlO2 và NaOH dư
- Phần chất rắn là Cu và Fe
Al + NaOH + H2O → NaAlO2 + 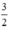 H2
H2
Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được chất rắn là Al2O3. Điện phân nóng chảy Al2O3 ta được Al.
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3 ↓
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
2Al(OH)3 → Al2O3 + 3H2O
2Al2O3 → 4Al + 3O2
Phần chất rắn đem hòa tan trong HCl dư, thu được dung dịch là FeCl2, còn phần chất rắn là Cu. Điện phân dung dịch thu được ta được Fe.
Fe + 2HCl → FeCl2 + H2
FeCl2 → Fe + Cl2

Cho dung dịch brom vào hỗn hợp khí, thấy dung dịch brom mất màu chứng tỏ trong hỗn hợp có SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4.
Thêm tiếp dung dịch brom vào hỗn hợp cho đến khi dung dịch Br2 hết bị mất màu như vậy hết SO2.
Dẫn hỗn hợp khí còn lại qua dung dịch nước vôi trong có dư thấy có kết tủa trắng chứng tỏ có CO2.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Dẫn khí còn lại qua bình đựng CuO (màu đen) đun nóng thấy có xuất hiện Cu màu đỏ thì khí đó là H2.
CuO + H2 → Cu + H2O

Trích mẫu thử
Cho các mẫu thử vào dung dịch axit sunfuric
- mẫu thử nào tạo kết tủa trắng là Ba
\(Ba + H_2SO_4 \to BaSO_4 + H_2\)
Cho các mẫu thử còn lại vào nước :
- mẫu thử nào tan,xuất hiện khí không màu là Na
\(2Na + 2H_2O \to 2NaOH + H_2\)
Cho dung dịch NaOH dư vào hai mẫu thử còn :
- mẫu thử nào tan,tạo khí không màu là Al
\(2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2\)
- mẫu thử nào không hiện tượng là Fe

1. \(Al_2O_3\underrightarrow{^{đpnc}}2Al+\dfrac{3}{2}O_2\)
\(NaCl\underrightarrow{^{đpnc}}Na+\dfrac{1}{2}Cl_2\)
\(PbO+H_2\underrightarrow{t^o}Pb+H_2O\)
\(Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\)
2. Gọi: \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Al_2O_3}=b\left(mol\right)\\n_{NH_4NO_3}=c\left(mol\right)\end{matrix}\right.\)
- Cho pư với KOH: \(n_{KOH}=0,25.2=0,5\left(mol\right)\)
BTNT K, có: nKAlO2 = nKOH = 0,5 (mol)
BTNT Al, có: nAl + 2nAl2O3 = nKAlO2 ⇒ a + 2b = 0,5 (1)
- Cho pư với HNO3: \(n_{N_2O}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
BTNT Al có: nAl(NO3)3 = nAl + 2nAl2O3 = a + 2b (mol)
Mà: mAl(NO3)3 + mNH4NO3 = 107,5 (g)
⇒ 213(a+2b) + 80c = 107,5
⇒ 213a + 426b + 80c = 107,5 (2)
BT e, có: 3nAl = 8nN2O + 8nNH4NO3 ⇒ 3a = 8.0,025 + 8c (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,2\left(mol\right)\\c=0,0125\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m=m_{Al}+m_{Al_2O_3}=0,1.27+0,2.102=23,1\left(g\right)\)

Tách hỗn hợp khí CH4 và CH3NH2
Cho hỗn hợp đi qua dung dịch HCl ta được CH3NH2 phản ứng với HCl bị giữ lại trong dung dịch, khí thoát ra ngoài là CH4 tinh khiết.
PTHH: CH3NH2 + HCl → CH3NH2Cl
Cho NaOH vào CH3NH2Cl thu lại được CH3NH2
CH3NH2Cl + NaOH → CH3NH2 + NaCl + H2O
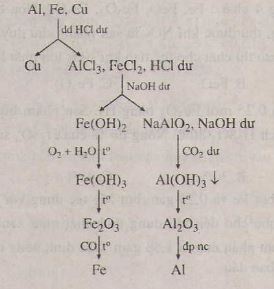
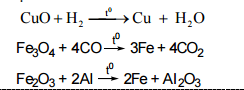
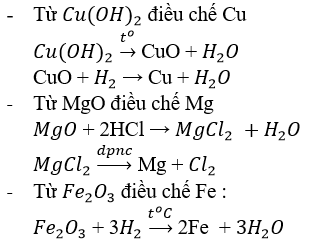
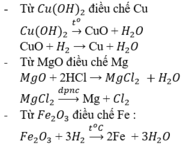
Cho dung dịch NaOH dư vào hỗn hợp 3 kim loại thu được hai phần.
- Phần dung dịch là NaAlO2 và NaOH dư
- Phần chất rắn là Cu và Fe
2Al + 2NaOH + H2O → NaAlO2 + 3H2
Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được chất rắn là Al2O3. Điện phân nóng chảy Al2O3 ta được Al.
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3 ↓
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
2Al(OH)3 \(-^{t^o}\rightarrow\) Al2O3 + 3H2O
2Al2O3 \(-^{đpnccriolit}\rightarrow\) 4Al + 3O2
Phần chất rắn đem hòa tan trong HCl dư, thu được dung dịch là FeCl2, còn phần chất rắn là Cu. Điện phân dung dịch thu được ta được Fe.
Fe + 2HCl → FeCl2 + H2
FeCl2 \(-^{đpdd\:}\rightarrow\) Fe + Cl2
Cho dung dịch NaOH dư vào hỗn hợp 3 kim loại thu được hai phần.
- Phần dung dịch là NaAlO2 và NaOH dư
- Phần chất rắn là Cu và Fe
2Al + 2NaOH + H2O → NaAlO2 + 3H2
Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được chất rắn là Al2O3. Điện phân nóng chảy Al2O3 ta được Al.