Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Nếu chỉ một trong hai muối tác dụng với Bạc nitrat :
Suy ra hai muối là NaCl và NaF
\(AgNO_3 + NaCl \to AgCl + NaNO_3\\ n_{NaCl} = n_{AgCl} = \dfrac{43,2}{143,5} = 0,3(mol)\\ \Rightarrow m_{NaCl} = 0,3.58,5 = 17,55 < 25,3(\text{thỏa mãn})\)
- Nếu cả hai muối đều tác dụng với Bạc nitrat :
Gọi CTTQ của hai muối : NaX
\(NaX + AgNO_3 \to AgX + NaNO_3\\ n_{NaX} = n_{AgX} \\ \Leftrightarrow \dfrac{25,3}{23 + X} = \dfrac{43,2}{108+X}\\ \Rightarrow X = 97,13\\ M_{Br} = 80 < M_X = 97,13 < M_I = 127\)
Vậy hai muối là NaBr và NaI

Đáp án D
Trường hợp 1: Hai halogen đều tạo được kết tủa với AgNO3
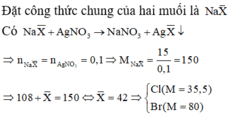
Do đó hai muối trong X là NaCl và NaBr
Trường hợp 2: Hai muối là NaF và NaCl
Phản ứng tạo thành kết tủa chỉ có AgCl và AgF là muối tan:
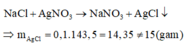
Do đó trường hợp này không thỏa mãn.

+) Trường hợp 1: Hỗn hợp gồm NaF và NaCl
PTHH: \(NaCl+AgNO_3\rightarrow AgCl\downarrow+NaNO_3\)
Ta có: \(n_{AgCl}=\dfrac{2,87}{143,5}=0,02\left(mol\right)=n_{NaCl}\)
\(\Rightarrow m_{NaCl}=0,02\cdot58,5=1,17\left(g\right)\) \(\Rightarrow m_{NaF}=0,415\left(g\right)\)
+) Trường hợp 2: Hỗn hợp không chứa NaF
Gọi công thức chung 2 muối là NaR
PTHH: \(NaR+AgNO_3\rightarrow NaNO_3+AgR\downarrow\)
Theo PTHH: \(n_{NaR}=n_{AgR}\) \(\Rightarrow\dfrac{1,595}{23+\overline{M}_R}=\dfrac{2,87}{108+\overline{M}_R}\)
\(\Rightarrow\overline{M}_R\approx83,3\) \(\Rightarrow\) 2 halogen cần tìm là Brom và Iot
Vậy 2 muối có thể là (NaF và NaCl) hoặc (NaBr và NaI)
*P/s: Các phần còn lại bạn tự làm

Tăng giảm khối lượng ta có; $n_{NaX}=\frac{2,35-1,5}{108-23}=0,01(mol)$
$\Rightarrow M_{NaX}=150\Rightarrow X=127$
Vậy CTHH của muối là NaI
Bảo toàn nguyên tố X và Ag ta có: $n_{AgNO_3}=n_{AgI}=0,01(mol)\Rightarrow C_{M}=1M$
PTHH: \(NaX+AgNO_3\rightarrow NaNO_3+AgX\downarrow\)
Theo PTHH: \(n_{NaX}=n_{AgX}\)
\(\Rightarrow\dfrac{1,5}{23+X}=\dfrac{2,35}{108+X}\) \(\Leftrightarrow X=127\) (Iot)
\(\Rightarrow\) Công thức: NaI
Ta có: \(n_{AgNO_3}=n_{NaI}=\dfrac{1,5}{150}=0,01\left(mol\right)\)
\(\Rightarrow C_{M_{AgNO_3}}=\dfrac{0,01}{0,01}=1\left(M\right)\)

Đáp án A
nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
![]() , MX =80 (Br)
, MX =80 (Br)

- Nếu một trong 2 muối là NaF => Muối còn lại là NaCl
\(n_{AgCl}=\dfrac{68,306}{143,5}=0,476\left(mol\right)\)
PTHH: NaCl + AgNO3 --> NaNO3 + AgCl
0,476<-----------------------0,476
=> mNaCl = 0,476.58,5 = 27,846(g)
=> mNaF = 35,411 - 27,846 = 7,565(g)
- Nếu trong A không có NaF
=> Gọi công thức của 2 muối là NaX
=> \(n_{NaX}=\dfrac{35,411}{23+M_X}\left(mol\right)\)
PTHH: NaX + AgNO3 --> NaNO3 + AgX
\(\dfrac{35,411}{23+M_X}\)----------------->\(\dfrac{35,411}{23+M_X}\)
=> \(\dfrac{35,411}{23+M_X}=\dfrac{68,306}{108+M_X}\)
=> \(M_X=68,5\)
=> 2 muối là NaCl, NaBr
Gọi số mol của NaCl, NaBr là a, b
=> 58,5a + 103b = 35,411
PTHH: NaCl + AgNO3 --> AgCl + NaNO3
a------------------>a
NaBr + AgNO3 --> AgBr + NaNO3
b------------------->b
=> 143,5a + 188b = 68,306
=> a = 0,1; b = 0,287
=> \(\left\{{}\begin{matrix}m_{NaCl}=0,1.58,5=5,85\left(g\right)\\m_{NaBr}=0,287.103=29,561\left(g\right)\end{matrix}\right.\)

Chia làm 2 trường hơp:
TH1: Giả sử cả 2 halogen đều tạo kết tủa với bạc.
Gọi công thức trung bình của 2 halogen là NaX:
NaX + AgNO3 ---> AgX (kết tủa) + NaNO3
3,87 170x 6,63 85x
Áp dụng định luật bảo toàn khối lượng ta có: 3,87 + 170x = 6,63 + 85x
Suy ra số mol phản ứng: x = 0,03247 mol.
Nguyên tử khối trung bình của 2 halogen là: X = 3,87/0,03247 - 23 = 96,18.
Như vậy 2 halogen cần tìm là Brom (80) và Iot (127).
TH2: Giả sử chỉ có 1 halogen tạo kết tủa với bạc, halogen còn lại không tạo kết tủa với bạc là Flo.
Vì 2 halogen liên tiếp nên halogen còn lại là Clo.
NaCl + AgNO3 ---> AgCl + NaNO3
nNaCl = nAgCl = 6,63/143,5 = 0,0462 mol.
mNaCl = 0,0462.58,5 = 2,7 g.
mNaF = 3,87 - 2,7 = 1,17 g.

- Nếu trong hh muối có NaF => muối còn lại là NaCl
(Thử lại => Thỏa mãn)
- Nếu trong hh muối không có NaF
Gọi công thức chung của 2 muối là NaX
\(n_{NaX}=\dfrac{42,6}{23+M_X}\left(mol\right)\)
PTHH: NaX + AgNO3 --> AgX + NaNO3
\(\dfrac{42,6}{23+M_X}\)-------->\(\dfrac{42,6}{23+M_X}\)
=> \(\dfrac{42,6}{23+M_X}\left(108+M_X\right)=85,1\)
=> MX = 62,2
Mà 2 halogen kế tiếp nhau
=> 2 halogen là Cl và Br
=> CTHH 2 muối là NaCl và NaBr