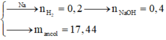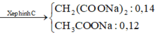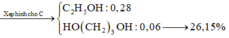Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C.
Lượng nhiệt cần dùng để làm tăng nhiệt độ của 1000 gam nước từ 25°C lên 100°C là:
Q = m.C nước. ∆ t ∘ = 1000.4,16.(100 - 75) = 312000 J = 312 kJ.
Trong 100 gam khí gas trên có 99,4 gam butan và 0,6 gam pentan nên lượng nhiệt tỏa ra khi đốt cháy 100 gam khí gas là:
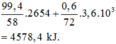
Vậy lượng khí gas cần dùng là 312.100.4578,4 ≈ 6,81 gam.

Đáp án : C
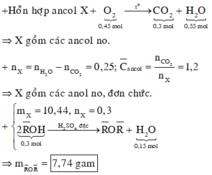
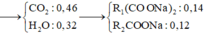
Đặt số mol của C3H8 là x => số mol C4H10 là 1,5x mol (cần dùng trong 45 ngày)
=> 44x + 58.1,5x = 12000 => x = 91,6 mol
C3H8 + 5O2 à 3CO2 + 4H2O
C4H10 + 6,5O2 à 4CO2 + 5H2O
nCO2 = 3x + 4.1,5x = 9x mol
=> mCO2/ngày = 806g

Chọn đáp án B
đốt E dạng C n H 2 n O 2 + 3 n - 2 2 O 2 → t o n C O 2 + n H 2 O
chọn n E = 1 m o l
⇒ n O 2 t r o n g b ì n h = 2 n O 2 c ầ n = 3 n - 2 m o l
điều kiện cùng T và V ⇒ n s a u : n t r ư ớ c = p s a u : p t r ư ớ c = 0 , 95 : 0 , 8
⇒ n s a u = 1 , 1875 × 3 n - 1 m o l = ∑ n C O 2 + n H 2 O + n O 2 c ò n d ư
⇄ 2n + (3n – 2) ÷ 2 = 1,1875 × (3n – 1)
⇒ n = 3 → CTPT của E là C 3 H 6 O 2 .

Đáp án B
Ta có: C 4 H 10 → c r a c k i n g C H 4 , C 3 H 6 C 2 H 6 , C 2 H 4 C 4 H 10 → t o C O 2 H 2 O → H 2 S O 4
Bản chất phản ứng chính là đốt cháy 5,8 (g) C4H10 ban đầu
n C 4 H 10 = 0 , 1 m o l → B T N T H n H 2 O = 1 / 2 n H = 0 , 1 . 10 2 = 0 , 5 m o l
Khối lượng bình đựng H2SO4 tăng chính là khối lượng H2O bị hấp thụ
→ m H 2 O = 0 , 5 . 18 = 9 g

Thủy phân este trong môi trường kiềm được gọi là phản ứng xà phòng hóa => Phát biểu (1) đúng.
Các este có nhiệt độ sôi thấp hơn các axit và ancol có cùng số nguyên tử cacbon => Phát biểu (2) đúng.
Đốt cháy hoàn toàn este no, đơn chức, mạch hở thu được số mol CO2 bằng số mol H2O => Phát biểu (3) sai.
Có thể dùng Cu(OH)2 để phân biệt Ala – Ala và Ala – Ala – Ala vì từ tripeptit trở lên có phản ứng màu biure với Cu(OH)2 tạo thành dung dịch màu tím => Phát biểu (4) đúng.
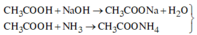
=> Phát biểu (5) sai.
Xenlulozơ trinitrat được dùng làm thuốc súng không khói => Phát biểu (6) sai.
Các phát biểu đúng là (1),(2),(4). Đáp án A