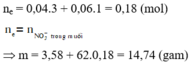Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
nHNO3 bị khử = nN (sp khử) = nNO + 2nN2 = 0,1 + 2.0,05 = 0,2 mol

Đáp án C
Phương pháp:
nHNO3 bị khử = nN (sp khử) = nNO + 2nN2
Hướng dẫn giải:
nHNO3 bị khử = nN (sp khử) = nNO + 2nN2 = 0,1 + 2.0,05 = 0,2 mol

Khi tỉ lệ số mol khác nhau, điều kiện phản ứng khác nhau

Cách 1 : $CH_2 + \dfrac{3}{2}O_2 \xrightarrow{t^o} CO_2 + H_2O$
Theo PTHH : $n_{O_2} = 1,5n_{CH_2}$
Cách 2 : Bảo toàn e
- Cacbon lên + 4 ; Hidro lên +1
Do đó số electron nhường là 4 + 1.2 = 6
- $O_2 + 4e \to 2O^{2-}$
Bảo toàn electron :$6n_{CH_2} = 4n_{O_2} \Rightarorw 1,5n_{CH_2} = n_{O_2}$

Chọn đáp án C
Giả sử mỗi chất có 1 mol khi đó sẽ xảy ra các phản ứng vừa đủ sau :
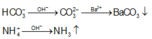
Do vậy Y là NaNO3

Fe là kim loại trung bình do đó thường ra khí $NO,NO_2$, hiếm khi tạo $N_2,N_2O$ và không tạo $NH_4NO_3$
SẢN PHẨM KHỬ có thể là những chất đó:
+Nếu Fe tác dụng với HNO3 loãng.
HOẶC sản phẩm khử không là chất đó nếu Fe tác dụng với HNO3 đặc nguội.