Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi tỉ lệ số mol khác nhau, điều kiện phản ứng khác nhau

Ta có: \(m_{b1tang}=m_{H_2O}\Rightarrow n_{H_2O}=\dfrac{0,117}{18}=0,0065\left(mol\right)\)
\(\Rightarrow n_H=2n_{H_2O}=0,013\left(mol\right)\)
\(m_{b2tang}=m_{CO_2}\Rightarrow n_{CO_2}=\dfrac{0,396}{44}=0,009\left(mol\right)\)
\(\Rightarrow n_C=2n_{CO_2}=0,009\left(mol\right)\)
Khi nung 1,35 g A thì thu được: \(n_{N_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
\(\Rightarrow\) Khi oxi hóa 0,135 g A thì thu được 0,0005 mol N2.
\(\Rightarrow n_N=2n_{N_2}=0,001\left(mol\right)\)
Vì đốt cháy A thu được CO2, H2O và N2 nên A chắc chắn có C, H, N và có thể có O.
Có: mC + mH + mN = 0,009.12 + 0,013.1 + 0,001.14 = 0,135 (g) = mA.
Vậy: A gồm C, H, N.
Giả sử CTPT của A là: CxHyNt (x, y, t nguyên dương).
⇒ x : y : t = 9 : 13 : 1
Vậy: CTĐGN của A là C9H13N.
Bạn tham khảo nhé!

cho hh khí vào nước vôi trong dư thì có 2,24 lít khí thoát ra => khí thoát ra là N2
=> V N2 = 2,24 => nN2 = 0,1 mol=> mN2 = 2,8 (g)
=> V CO2 = 8,96 - 2,24 = 6,72 (l) => nCO2 = 0,3 mol => mCO2 = 0,3.44= 13,2 (g)
=> mhh = 2,8 + 13,2 = 16
% N2 = \(\frac{2,8}{16}.100\%=17,5\%\)
=> %CO2 = 82,5%

Đáp án B
Phương pháp : Cân bằng phương trình bằng phương pháp thăng bằng electron.
Hướng dẫn giải:
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O+ 15H2O
Số phân tử HNO3 môi trường = 24
Số phân tử HNO3 oxi hóa = 6
=> Tỉ lệ 4 :1

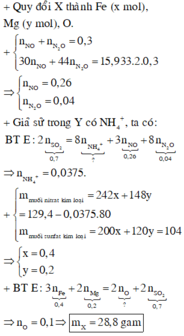

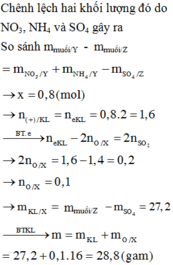
Fe là kim loại trung bình do đó thường ra khí $NO,NO_2$, hiếm khi tạo $N_2,N_2O$ và không tạo $NH_4NO_3$
SẢN PHẨM KHỬ có thể là những chất đó:
+Nếu Fe tác dụng với HNO3 loãng.
HOẶC sản phẩm khử không là chất đó nếu Fe tác dụng với HNO3 đặc nguội.