
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1:
(1) \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
(2) \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
(3) \(AlCl_3+3KOH\rightarrow3KCl+Al\left(OH\right)_3\downarrow\)
(4) \(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
(5) \(2Al\left(OH\right)_3\xrightarrow[]{t^o}Al_2O_3+3H_2O\)
(6) \(Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+2H_2O\)
(7) \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
(8) \(Al+NaOH+H_2O\rightarrow NaAlO_2+\dfrac{3}{2}H_2\uparrow\)
(9) \(2Al_2O_3\xrightarrow[criolit]{đpnc}4Al+3O_2\)
Bài 2:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
a_______a_______a_____a (mol)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
b_______b________b____b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+24b=21,6\\a+b=\dfrac{11,2}{22,4}=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,3\cdot56}{21,6}\cdot100\%\approx77,78\%\\\%m_{Mg}=22,22\%\end{matrix}\right.\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Mg\left(OH\right)_2}=n_{Mg}=0,2\left(mol\right)\\n_{Fe\left(OH\right)_2}=n_{Fe}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{kết.tủa}=m_{Fe\left(OH\right)_3}+m_{Mg\left(OH\right)_2}=0,3\cdot107+0,2\cdot56=43,3\left(g\right)\)
Theo các PTHH: \(n_{H_2SO_4\left(p/ứ\right)}=0,5\left(mol\right)\) \(\Rightarrow n_{H_2SO_4\left(ban.đầu\right)}=0,5\cdot120\%=0,6\left(mol\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,6\cdot98}{10\%}=588\left(g\right)\)
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,2\left(mol\right)\\n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{chất.rắn}=m_{MgO}+m_{Fe_2O_3}=0,2\cdot40+0,15\cdot160=32\left(g\right)\)

Bài 8:
a). 2NaOH + H2SO4 → Na2SO4 + 2H2O
2 1 1 2
0,6 0,3 0,3 0,6
200ml = 0,2l
nH2SO4= CM . V = 1,5 . 0,2 = 0,3 (mol)
nNaOH = \(\dfrac{0,3.2}{1}\)= 0,6(mol)
mNaOH= n . M = 0,6 . 40 = 24(g)
⇒ mddNaOH = \(\dfrac{m_{ct}.100\%}{C\%}\)= \(\dfrac{24.100\%}{20\%}\)= 120(g).
b). Ta có: mH2SO4= n . M = 0,3 . 98 =29,4(g).
mH2O = n . M = 0,6 . 18 = 10,8 (g).
Ta lại có: mddNa2SO4 = mddNaOH + mH2SO4 - mH2O
= 120 + 29,4 - 10,8
= 138,6(g).
mctNa2SO4= n . M = 0,3 . 142 = 42,6(g)
C%Na2SO4 = \(\dfrac{m_{ct}}{m_{dd}}\).100%=\(\dfrac{42,6}{138,6}\).100% ∼ 30,74%
Bài 9:
Đặt công thức oxit của KL là RO
RO + 2HCl → RCl2 + H2O
Ta có: mHCl =\(\dfrac{600.3,65}{100\%}\)= 21,9(g)
⇒nHCl = \(\dfrac{21,9}{36,5}\)= 0,6(mol).
Từ PT trên, có: nRO = \(\dfrac{1}{2}\)nHCl =0,3(mol)
2,4 : (R+16) =0,3
tự bấm ra kq nhé, bị bắt đi ngủ r:) thông cảm ạ

PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(\left\{{}\begin{matrix}m_{H_2SO_4}=588\cdot5\%=29,4\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\) \(\Rightarrow\) Al2O3 còn dư
\(\Rightarrow n_{Al_2\left(SO_4\right)_3}=0,1\left(mol\right)=n_{Al_2O_3\left(dư\right)}\)
\(\Rightarrow C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1\cdot342}{20,4+588-0,1\cdot102}\cdot100\%\approx5,72\%\)

6
Gọi x , y lần lượt là số mol của Al và Fe
\(n_{H_2}\)\(=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2 \)
x \(\rightarrow\) \(\dfrac{3}{2}x\) (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
y \(\rightarrow\) y (mol)
Từ trên ta có hpt
\(\left\{{}\begin{matrix}27x+56y=11\\\dfrac{3}{2}x+y=0.4\end{matrix}\right.\)
giải ra ta được
x=0.2-) mAl=0.2*27=5.4(g) =))\(\%Al=\dfrac{5.4}{11}\cdot100=49.1\%\)
y=0.1-)mFe=0.1*56=5.6(g) =))\(\%Fe=\dfrac{5.6}{11}\cdot100=50.9\%\)
5
Cu không pư được H2SO4 nên 6.4(g) chất rắn còn lại sau pư là Cu
\(m_{Fe}=10-6.4=3.6\left(g\right)\)
pthh:
\(Fe+H_2So_4\Rightarrow FeSo_4+H_2\)
\(\left\{{}\begin{matrix}\%Cu=\dfrac{0.1\cdot64}{10}\cdot100=64\%\\^{\%Fe=\dfrac{3.6}{10}\cdot100=36\%}\end{matrix}\right.\)

Đổi 100ml = 0,1 lít
Ta có: \(n_{HCl}=2.0,1=0,2\left(mol\right)\)
a. PTHH: \(AgNO_3+HCl--->AgCl\downarrow+HNO_3\)
Theo PT: \(n_{AgNO_3}=n_{HCl}=0,2\left(mol\right)\)
Đổi 200ml = 0,2 lít
=> \(C_{M_{AgNO_3}}=\dfrac{0,2}{0,2}=1M\)
b. Ta có: \(m_{dd_{HNO_3}}=0,1\left(lít\right)\)
Theo PT: \(n_{HNO_3}=n_{HCl}=0,2\left(mol\right)\)
=> \(C_{M_{HNO_3}}=\dfrac{0,2}{0,1}=2M\)

d) Gọi x,y lần lượt là số mol Al, Fe
\(\left\{{}\begin{matrix}27x+56y=8,3\\1,5x+y=0,25\end{matrix}\right.\)
=> x=0,1 ; y=0,1
Kết tủa : Al(OH)3, Fe(OH)2
Bảo toàn nguyên tố Al: \(n_{Al\left(OH\right)_3}=n_{Al}=0,1\left(mol\right)\)
Bảo toàn nguyên tố Fe: \(n_{Fe\left(OH\right)_2}=n_{Fe}=0,1\left(mol\right)\)
=> \(m=0,1.78+0,1.90=16,8\left(g\right)\)
Nung kết tủa thu được chất rắn : Al2O3 và FeO
Bảo toàn nguyên tố Al: \(n_{Al_2O_3}.2=n_{Al}\Rightarrow n_{Al_2O_3}=0,05\left(mol\right)\)
Bảo toàn nguyên tố Fe: \(n_{FeO}=n_{Fe}=0,1\left(mol\right)\)
=> \(a=0,05.102+0,1.72=12,3\left(g\right)\)

Mình đang càn gấp câu c ạ, mọi người giúp mình câu c được không ạ??
Gọi nMg=x mol, nAl=y mol
nH2=\(\dfrac{5,6}{22,4}=0,25mol\)
Mg + 2HCl → MgCl2 + H2
x → 2x → x → x
2Al + 6HCl → 2AlCl3 + 3H2
y → 3y → y → 1,5y
\(\left\{{}\begin{matrix}24x+27y=5,1\\x+1,5y=0,25\end{matrix}\right.\) ⇔ \(\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
a) %Mg=\(\dfrac{0,1.24}{5,1}.100\%\approx47,06\%\)
%Al = 100% - 47,06%=52,94%
b) nHCl=2x+3y=0,1.2+0,1.3=0,5 mol
mHCl = 0,5 . 36,5=18,25g
m=\(\dfrac{18,25.100}{10}=182,5g\)
c) MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
x → x
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
y → y
a = mMg(OH)2 + mAl(OH)3
= 0,1.58 + 0,1.78 =13,6g

Bài 11:
\(PTHH:2A+Cl_2\rightarrow2ACl\\TheoĐLBTKL:\\ m_A+m_{Cl_2}=m_{ACl}\\ \Leftrightarrow 9,2+m_{Cl_2}=23,4\\ \Rightarrow m_{Cl_2}=23,4-9,2=14,2\left(g\right)\\ n_{Cl_2}=\dfrac{14,2}{71}=0,2\left(mol\right)\\ n_A=2.0,2=0,4\left(mol\right)\\ M_A=\dfrac{9,2}{0,4}=23\left(\dfrac{g}{mol}\right)\\ \Rightarrow A\left(I\right):Natri\left(Na=23\right)\)

5.
\(n_{Na}=a\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(a...............a.....0.5a\)
\(m_{\text{dung dịch sau phản ứng}}=23a+500-0.5a\cdot2=22a+500\left(g\right)\)
\(m_{NaOH}=40a\left(g\right)\)
\(C\%_{NaOH}=\dfrac{40a}{22a+500}\cdot100\%=20\%\)
\(\Rightarrow a=2.8\)
\(b.\)
\(n_{H^+}=10^{-3}\cdot V\cdot\left(1+0.5\cdot2\right)=2\cdot10^{-3}V\left(mol\right)\)
\(\Rightarrow n_{NaOH}=2\cdot10^{-3}V=2.8\left(mol\right)\)
\(\Rightarrow V=1400\)



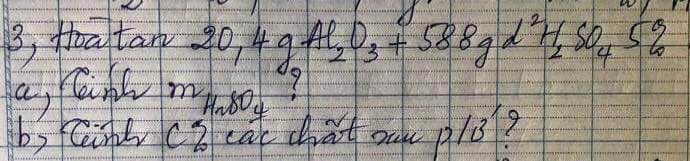

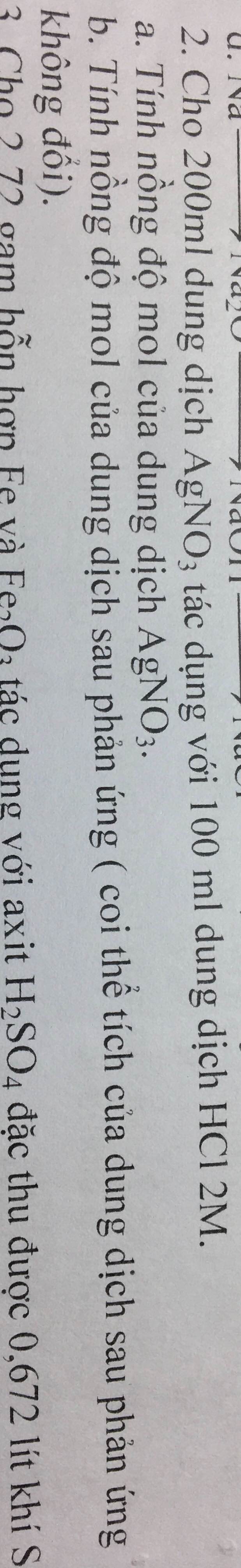





\(a,n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\\ n_A=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
PTHH:
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
0,2<---------------------0,2
CH4 + 2O2 --to--> CO2 + 2H2O
a--------------------->a
C2H4 + 3O2 --to--> 2CO2 + 2H2O
b----------------------->2b
b, => \(\left\{{}\begin{matrix}a+b=0,125\\a+2b=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,075\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,05}{0,125}.100\%=40\%\\\%V_{C_2H_4}=100\%-40\%=60\%\end{matrix}\right.\)