
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(n_{Fe}=a;n_{Cu}=b\\ 56a+64b=9,2\left(I\right)\\ BTe^{^{ }-}:3a+2b=2n_{SO_2}\left(II\right)\\ n_{H_2SO_4pư}=n_{SO_2}+1,5a+b\\ n_{H_2SO_4sau}=\dfrac{50.0,98}{98}-n_{SO_2}-1,5a-b=0,5-n_{SO_2}-1,5a-b\\ m_{ddsau}=9,2+50-64n_{SO_2}=59,2-64n_{SO_2}\\ \Rightarrow:\dfrac{98\left(0,5-n_{SO_2}-1,5a-b\right)}{59,2-64n_{SO_2}}=\dfrac{30,625}{100}\left(III\right)\\ \Rightarrow a=0,05;b=0,1;n_{SO_2}=0,175mol\\ V=0,175.22,4=3,92L\\ \%m_{Fe}=\dfrac{0,05.56}{9,2}.100\%=30,43\%\\ \%m_{Cu}=69,57\%\)

Câu 1:
\(n_{Ca\left(OH\right)_2}=1,8.0,05=0,09\left(mol\right)\)
BTNT Ca, có: \(n_{CaCO_3}=n_{Ca\left(OH\right)_2}=0,09\left(mol\right)\)
Mà: mCaCO3 + mBaCO3 = 18,85 (g)
\(\Rightarrow n_{BaCO_3}=\dfrac{18,85-0,09.100}{197}=0,05\left(mol\right)\)
BTNT C, có: nCO2 = nCaCO3 + nBaCO3 = 0,14 (mol) = nC
Sau pư với Ca(OH)2 có: \(\left\{{}\begin{matrix}n_{CaCO_3}+2n_{Ca\left(HCO_3\right)_2}=0,14\\n_{CaCO_3}+n_{Ca\left(HCO_3\right)_2}=0,09\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{CaCO_3}=0,04\left(mol\right)\\n_{Ca\left(HCO_3\right)_2}=0,05\left(mol\right)\end{matrix}\right.\)
Có: m dd tăng = mCO2 + mH2O - m kết tủa
⇒ 3,78 = 0,14.44 + 18nH2O - 0,04.100 ⇒ nH2O = 0,09 (mol)
⇒ nH = 0,09.2 = 0,18 (mol)
\(\Rightarrow n_N=\dfrac{2,14-0,14.12-0,18.1}{14}=0,02\left(mol\right)\)
Gọi: CTPT của A là CxHyNt
⇒ x:y:t = 0,14:0,18:0,02 = 7:9:1
Vậy: CTĐGN của A là C7H9N.





| KHHH | Tên NT | NTK | STT | Chu kì | Nhóm | Số p | Số e | Điện tích hạt nhân |
| Si | Silic | 28 đvC | 14 | 3 | IVA | 14 | 14 | 14+ |
| P | Photpho | 31 đvC | 15 | 3 | VA | 15 | 15 | 15+ |
| K | Kali | 39 đvC | 19 | 4 | IA | 19 | 19 | 19+ |
| Ca | Canxi | 40 đvC | 20 | 4 | IIA | 20 | 20 | 20+ |



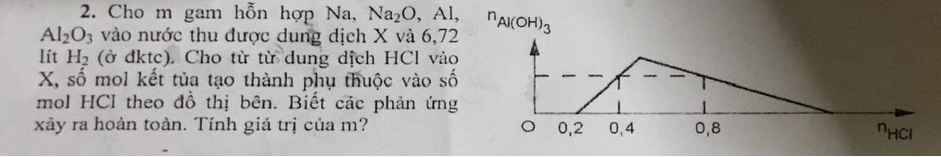 Nhờ mn giúp mik vs ạ
Nhờ mn giúp mik vs ạ







\(n_{CuSO_4}=0,2x\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,2x 0,2x 0,2x
\(m_{tăng}=m_{Cu}-m_{Fe}=64\cdot0,2x-56\cdot0,2x=1,6\)
\(\Rightarrow x=1M\)
Chọn C.
\(n_{Fe}=n_{FeSO_4}=n_{Cu}=n_{CuSO_4}=0,2.x\left(mol\right)\\ Fe+CuSO_4\rightarrow FeSO_4+Cu\\ m_{t\text{ăn}g}=m_{Cu.b\text{á}m.v\text{ào}}-m_{Fe.tan.ra}\\ \Leftrightarrow1,6=64.0,2x-56.0,2x\\ \Leftrightarrow x=1\\ \Rightarrow C\)