Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
Phản ứng phân hủy
b) \(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
PTHH: 2KNO3 --to--> 2KNO2 + O2
0,15<--------------------0,075
=> \(m_{KNO_3\left(PTHH\right)}=0,15.101=15,15\left(g\right)\)
=> mKNO3 (thực tế) = \(\dfrac{15,15.100}{85}=17,824\left(g\right)\)
c) \(n_{KNO_3\left(pư\right)}=\dfrac{10,1.80\%}{101}=0,08\left(mol\right)\)
=> nO2 = 0,04 (mol)
=> VO2 = 0,04.22,4 = 0,896(l)

a.
KN03 --> KN02 + 1/2 02
b.
n 02 = 0,075 mol
mà H% đạt 85%
=> n 02 lí thuyết thu đc = 0,075*100/85 = 3/34 mol
KN03 --> KN02 + 1/2 02
3/17 mol <---- 3/34 mol
vậy n KN03 = 3/17 mol
c.
n KN03 = 0,1
KN03 ---> KN02 + 1/2 02
lí thuyết:..0,1 -----------------> 0,05
mà H% = 80%
=> n 02 thu được = 0,05*80/100 = 0,04 mol
=> V 02 thực tế thu dc = 0,896 lit

\(n_{O_2}=\dfrac{0,64}{32}=0,02mol\\ 2KNO_3\xrightarrow[]{t^0}2KNO_2+O_2\\ n_{KNO_3\left(lí.thuyết\right)}=0,02.2=0,04mol\\ n_{KNO_3\left(thực.tế\right)}=0,04:80\%=0,05mol\\ m_{KNO_3\left(cần\right)}=0,05.101=5,05g\\ \Rightarrow B\)

a) PTHH:
2KNO3→2KNO2 + O2
b)\(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)Theo PTHH ta có:
nKNO3=2nO2=0,15(mol)
mKNO3 ban đầu=0,15.101=15,15(g)
mKNO3 thực tế=15,15.\(\dfrac{85}{100}\)=12,8775(g)

Hướng dẫn: câu a, lập phương trình tự làm nha
b, có 6,4 g O2 thì tính được mol O2, theo phương trình tính được mol KNO3 rồi tính được khối lượng KNO3. mKNO3(thực tế)=mKNO3(tính theo PTHH)x100/H
c, tương tự câu b nhưng mO2(thực tế)=mO2(lý thuyết)xH/100
a. PTHH: \(2KNO_3\rightarrow2KNO_2+O_2\)
b. \(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\)
Theo PT ta có: \(n_{KNO_3\left(theoPT\right)}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
\(n_{KNO_3\left(thực-tế\right)}=0,4:85\%=\dfrac{8}{17}\left(mol\right)\)
=> \(m_{KNO_3\left(thực-tế\right)}=\dfrac{8}{17}.101\approx47,53\left(g\right)\)
c. \(n_{KNO_3}=\dfrac{20,2}{101}=0,2\left(mol\right)\)
=> \(n_{KNO_3\left(pư\right)}=0,2.80\%=0,16\left(mol\right)\)
=> \(n_{O_2}=\dfrac{0,16.1}{2}=0,08\left(mol\right)\)
=> \(V_{O_2}=0,08.22,4=1,792\left(l\right)\)

2KNO3\(\rightarrow\)2KNO2 + O2
b;nO2=\(\dfrac{2,4}{32}=0,075\left(mol\right)\)
Theo PTHH ta có:
nKNO3=2nO2=0,15(mol)
mKNO3 ban đầu=0,15.101=15,15(g)
mKNO3 thực tế=15,15.\(\dfrac{85}{100}=12,8775\left(g\right)\)
c;
nKNO3=\(\dfrac{10,1}{101}=0,1\left(mol\right)\)
Theo PTHH ta có:
\(\dfrac{1}{2}\)nKNO3=nO2=0,05(mol)
mO2 ban đầu=32.0,05=1,6(g)
mO2 thu được=1,6\(\dfrac{85}{100}=1,36\left(g\right)\)

a)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.5__________________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2KClO3 -to-> 2KCl + 3O2
0.5_______________0.75
VO2 = 0.75*22.4 = 16.8 (l)
2KNO3 -to-> 2KNO2 + O2
0.5________________0.25
VO2 = 0.25*22.4 = 5.6 (l)
2HgO -to-> 2Hg + O2
0.5____________0.25
VO2 = 0.25*22.4 = 5.6 (l)
b)
nKNO3 = 50/101 (mol)
2KNO3 -to-> 2KNO2 + O2
50/101______________25/101
VO2 = 25/101 * 22.4 = 5.54 (l)
nHgO = 50/217 (mol)
2HgO -to-> 2Hg + O2
50/217 _________25/217
VO2 = 2.58 (l)
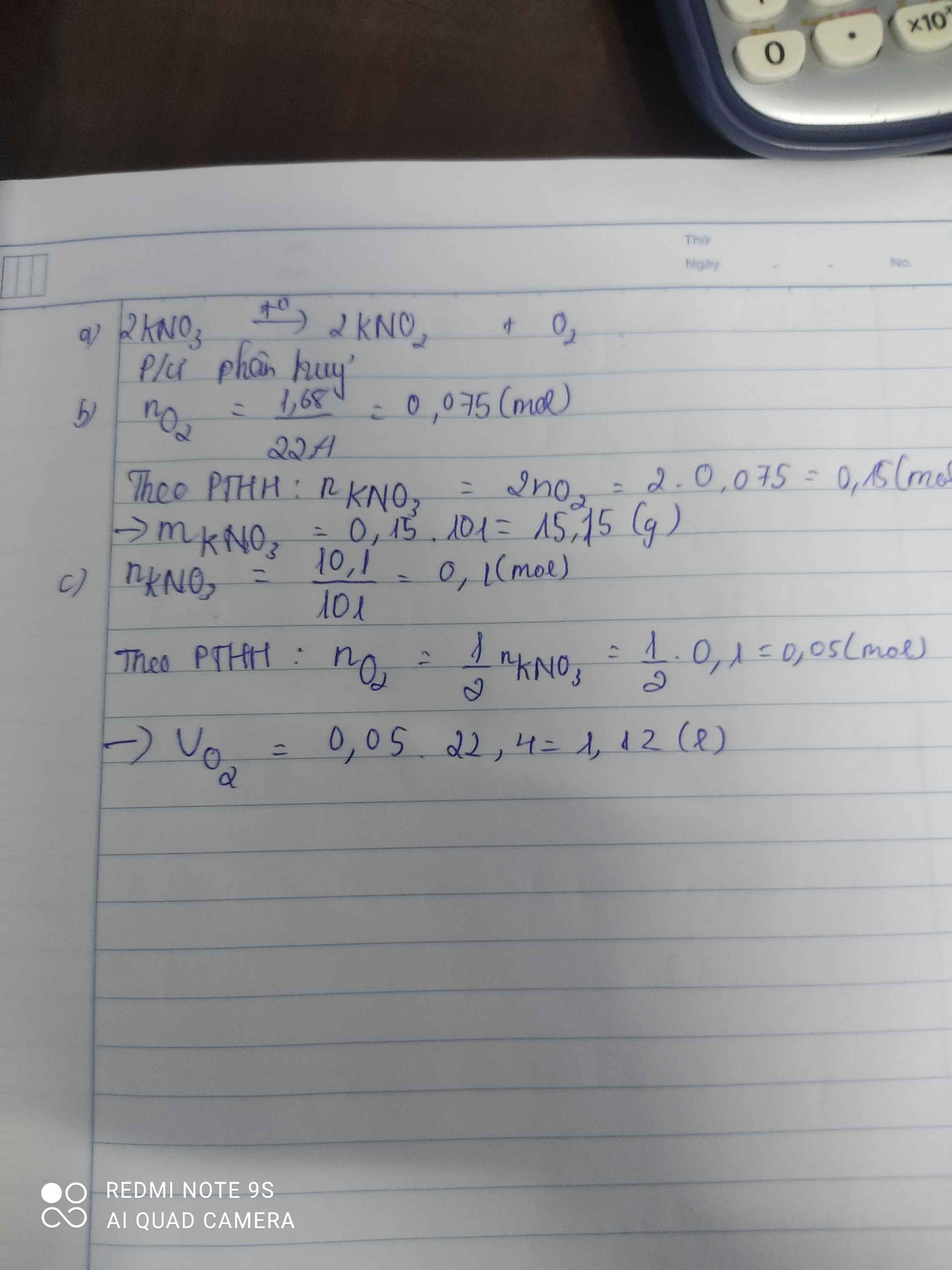
a) PTHH: 2KNO3 -> (t°) 2KNO2 + O2
b) nKNO3 = 35,35/101 = 0,35 (mol)
nKNO2 = nKNO3 = 0,35 (mol)
mKNO2 = 0,35 . 85 = 29,75 (g)
c) nKNO3 = 40,4/101 = 0,4 (mol)
nO2(LT) = 0,4/2 = 0,2 (mol)
nO2(TT) = 0,2 . 75% = 0,15 (mol)
VO2 = 0,15 . 22,4 = 3,36 (l)
2KNO3-to>2KNO2+O2
0,35-----------0,35 mol
n KNO3=\(\dfrac{35,35}{101}=0,35mol\)
=>m KNO2=0,35.85=29,75g
c)
2KNO3-to>2KNO2+O2
0,4----------------------0,2 mol
n KNO3=\(\dfrac{40,4}{101}\)=0,4 mol
H=75%
=>VO2=0,2.22,4.\(\dfrac{75}{100}\)=3,36l