Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)

1) nZn=13/65=0,2(mol)
PTHH: Zn + 2 HCl -> ZnCl2 + H2
nH2=nZnCl2=nZn=0,2(mol)
nHCl=2.0,2=0,4(mol)
=> mHCl=0,4 x 36,5=14,6(g)
=> mddHCl=(14,6.100)/8=182,5(g)
2) V(H2,đktc)=0,2 x 22,4= 4,48(l)
mZnCl2=0,2.136=27,2(g)
3) mddsau=mZn+mddHCl - mH2= 13+182,5-0,2.2=195,1(g)
4) C%ddZnCl2=(27,2/195,1).100=13,941%

\(Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{HCl}=0,3.0,15=0,045\left(mol\right)\\ n_{Zn}=n_{H_2}=\dfrac{0,045}{2}=0,0225\left(mol\right)\\ a,m_{Zn}=0,0225.65=1,4625\left(g\right)\\ b,V_{H_2\left(đktc\right)}=22,4.0,0225=0,504\left(l\right)\\ c,n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ Vì:\dfrac{0,3}{1}>\dfrac{0,045}{2}\Rightarrow Zndư\\ \Rightarrow n_{ZnCl_2}=\dfrac{0,045}{2}=0,0225\left(mol\right)\\ m_{ZnCl_2}=0,0225.136=3,06\left(g\right)\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\)
a) Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2|\)
1 2 1 1
0,1 0,1 0,05
b) Lập tỉ số so sánh : \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\)
⇒ Zn dư , HCl phản ứng hết
⇒ Tính toán dựa vào số mol của HCl
\(n_{ZnCl2}=\dfrac{0,1.1}{2}=0,05\left(mol\right)\)
⇒ \(m_{ZnCl2}=0,05.136=6,8\left(g\right)\)
Chúc bạn học tốt

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,3.65=19,5\left(g\right)\)
c, \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,1}=6\left(M\right)\)

Gọi \(n_{Fe}=x\left(mol\right)\)\(;n_{Zn}=y\left(mol\right)\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
Ta có: \(\left\{{}\begin{matrix}56x+65y=18,6\\2x+2y=2n_{H_2}=0,6\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\%m_{Fe}=\dfrac{0,1\cdot56}{18,6}\cdot100\%=30,11\%\)
\(\%m_{Zn}=100\%-30,11\%=69,89\%\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,4
\(n_{HCl}=0,2+0,4=0,6mol\)
\(C_M=\dfrac{n}{V}=\dfrac{0,6}{0,2}=3M\)

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

400ml = 0,4l
\(n_{H2SO4}=0,5.0,4=0,2\left(mol\right)\)
Pt : \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2|\)
1 1 1 1
0,2 0,2
\(n_{ZnSO4}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{ZnSO4}=0,2.161=32,2\left(g\right)\)
Chúc bạn học tốt
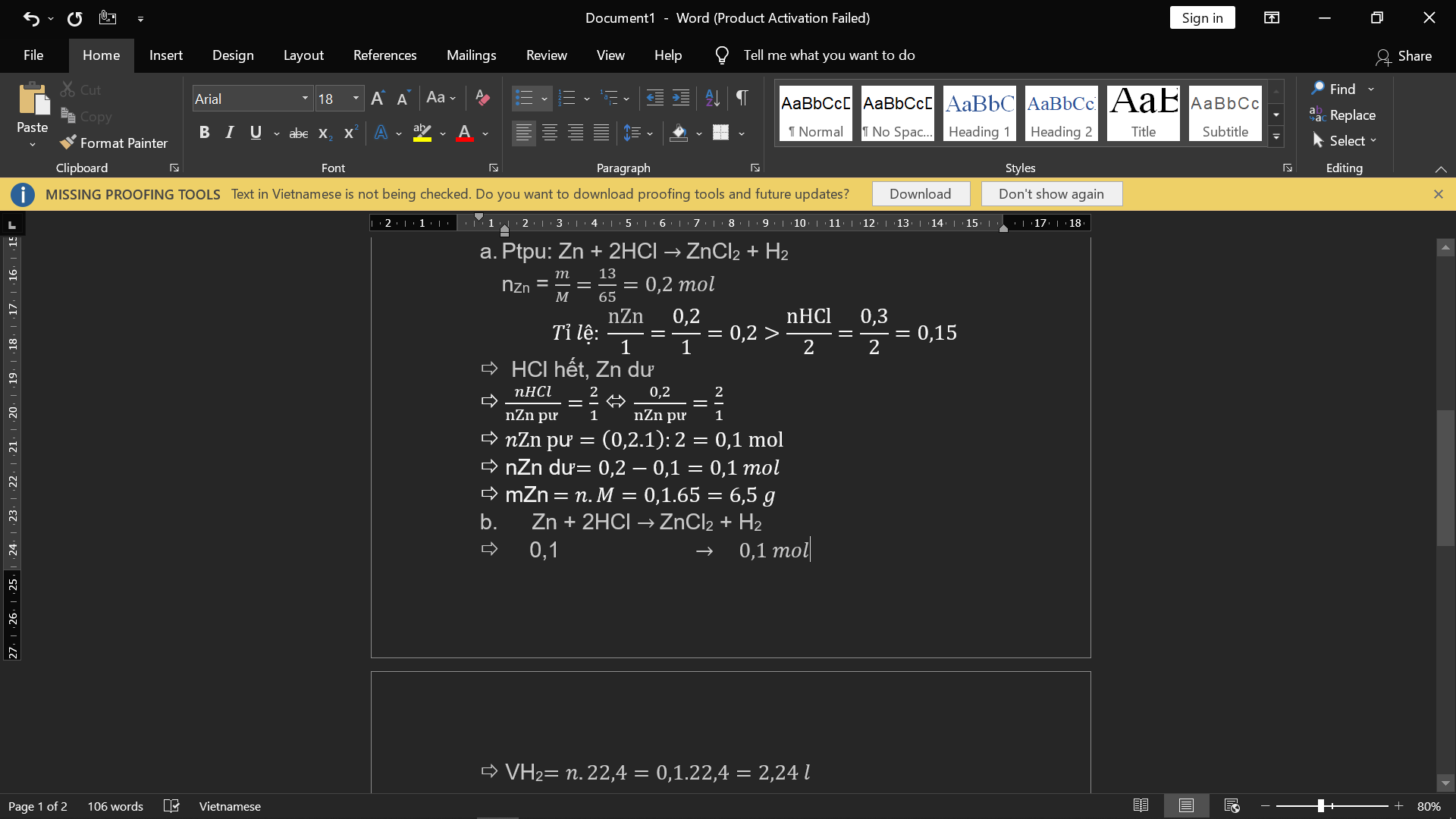

PTHH: Zn + 2HCl ==> ZnCl2 + H2
Ta có: nZn = \(\frac{13}{65}=0,2\left(mol\right)\)
Lập tỉ lệ số mol: \(\frac{0,2}{1}< \frac{0,3}{2}\)
=> Zn dư, HCl hết
=> Tính theo số mol HCl
Theo PTHH, nZnCl2 = \(\frac{0,3}{2}=0,15\left(mol\right)\)
=> mZnCl2 = 0,15 x 136 = 20,4 (gam)
theo mk là thế sai xin lỗi nha