Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tác dụng với 1 số kim loại:
PTHH: 2K + 2 H2O → 2KOH + H2
Tác dụng với 1 số oxit bazơ:
PTHH: CaO + H2O → Ca(OH)2
Tác dụng với 1 số oxit axit:
PTHH: SO3 + H2O → H2SO4
2M + 2nH2O → 2M(OH)n + nH2↑
Ví dụ:
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Kim loại Mg tan rất chậm trong nước nóngMột số kim loại trung bình như Mg, Al, Zn, Fe…phản ứng được với hơi nước ở nhiệt độ cao tạo oxit kim loại và hiđroVí dụ:
Mg + H2Ohơi →MgO + H2
3Fe + 4H2Ohơi → Fe3O4+ 4H2
Fe + H2Ohơi → FeO + H2
2. Nước tác dụng với oxit bazoNước tác dụng với oxit bazơ tạo thành dung dịch bazo tương ứng.
H2O + Oxit bazơ→ Bazơ
Na2O + H2O → 2NaOH
Li2O +H2O→ 2LiOH
K2O +H2O→ 2KOH
CaO + H2O → Ca(OH)2
3. Nước tác dụng với oxit axitNước tác dụng với oxit axit tạo thành axit tương ứng.
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3

Tham khảo:
- Nước tác dụng với kim loại:Nước tác dụng được với một số kim loại ở nhiệt độ thường như: Li, Na, K, Ca… tạo thành bazơ và khí H2.
Ví dụ:
2Na + 2H2O → 2NaOH + H2 ↑
Ca + 2H2O → Ca(OH)2 + H2 ↑
- Nước tác dụng với oxit bazơ:Nước tác dụng với một số oxit bazơ như Na2O, K2O, CaO … tạo thành dung dịch bazơ tương ứng. Dung dịch bazơ làm quỳ tím hóa xanh.
Ví dụ: Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
- Nước tác dụng với oxit axit:Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
Ví dụ:
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4

- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Cu + O2 \(\Rightarrow t^o\)\(2CuO\)\(\)
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
2H2 + O2 \(2H_2O\)
- Tác dụng với một số phi kim khác:
4P + 5O2 \(\rightarrow t^o\)\(2P_2O_5\)
+ Tác dụng với một số hợp chất:
2C2H6 + 7O2 \(\rightarrow t^o4CO_2\)\(+6H_2O\)

a) bạn tự học SGK
b) Nguyên liệu điều chế O2: KMnO4, KClO3, KNO3 (độc), H2O,...
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
2KClO3 -> (t°, MnO2) 2KCl + 3O2
2KNO3 -> (t°) 2KNO2 + O2
2H2O -> (đp) 2H2 + O2
Nguyên liệu điều chế H2: Pb, Zn, Fe, Al, HCl, H2SO4 loãng,...
Fe + 2HCl -> FeCl2 + H2
2Al + 3H2SO4 ->
Al2(SO4)3 + 3H2
2H2O -> (đp) 2H2 + O2

REFER
Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Cụ thể:
- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Ví dụ:
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
Phương trình hóa học:
- Tác dụng với một số phi kim khác:
Ví dụ:
+ Tác dụng với một số hợp chất:
Ví dụ:

- Tác dụng với kim loại:
Nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
- Tác dụng với một số oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
\(K_2O+H_2O\rightarrow2KOH\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
- Tác dụng với oxit axit như SO3, P2O5… tạo thành axit tương ứng H2SO4, H3PO4,…
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)

- Hiện tượng: Xuất hiện kết tủa trắng.
→ KL: muối tác dụng với muối tạo 2 muối mới.
PT: \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_{4\downarrow}\)

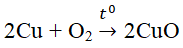
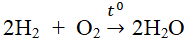
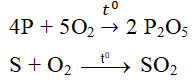
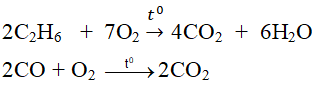
H2 tác dụng với:
a) O2 ( H2 cháy với ngọn lửa màu xanh):
2H2 + O2 ---> 2H2O
b) Tác dụng với đồng(II) oxit hay oxit bazo:
H2 + CuO ---> Cu + H2O
* Điều chế H2 trong phòng thí nghiệm:
+ Thu bằng cách đẩy không khí
+ Thu bằng cách đẩy nước