Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
Áp dụng ĐLBT khối lượng => mX = mY
<=> nX.MX = nY.MY
<=> \(\dfrac{nX}{nY}=\dfrac{M_Y}{M_X}\) = \(\dfrac{6}{5}\)
Chọn nX = 6 và nY = 5
=> Số mol H2 phản ứng = số mol hh khí giảm = nX - nY = 6-5 =1 mol
My = 4.4 = 16 (g/mol) và phản ứng xảy ra hoàn toàn => Hỗn hợp Y gồm ankan và H2 dư
nAnkan = nH2 phản ứng = 1 mol
nH2 dư = nY - nAnkan = 4 mol
mY = mAnkan + mH2 = 1.(14n+2) + 4.2 = 16.5
=> n = 5 Vậy anken là C5H10 => Chọn D
Câu 2:
mdd brom tăng = mAnken = 2,8 gam
nAnken = 1,12 :22,4 = 0,05 mol
=> MAnken = \(\dfrac{2,8}{0,05}\)= 56 (g/mol)
<=> 14n = 56 => n = 4 , anken là C4H8
C4H8 + Br2 → C4H8Br2
theo pt => nBr2 phản ứng = nAnken = 0,05 mol
<=> mBr2 = 0,05.160 = 8 gam
=> Chọn B

Đáp án C
hhX gồm hai anken kế tiếp và H2 dư có dX/H2 = 6,875.
Nung X với Ni → hhY có dY/H2 = 55/6.
• Giả hhX gồm hai anken có CT là CnH2n x mol và H2 dư y mol.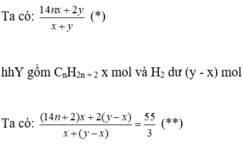
Từ (*), (**) → x = 3y → n = 3,5
→ Hai anken là C3H6 và C4H8

Đáp án D
► Giả sử có 1 mol X. Đặt nH2 = x; nC3H6 = y ⇒ nX = x + y = 1 mol.
mX = 2x + 42y = 1 × 5,5 × 4 ||⇒ giải hệ có: x = y = 0,5 mol.
● Bảo toàn khối lượng: mY = mX = 22(g) ⇒ nY = 22 ÷ 27,5 = 0,8 mol.
||⇒ nCH6 phản ứng = ∆n = nX – nY = 0,2 mol ||► H = 0,2 ÷ 0,5 × 100% = 40%

Đáp án A
Hướng dẫn
Giả sử có 1 mol hỗn hợp X gồm H2 và anken : CnH2n
Ta có: M - X = 9,1.2 = 18,2 ; M _ Y = 13.2 =26
Áp dụng ĐLBTKL ta có: mhhX = mhhY <=> nX. M _ X = nY. M - Y
<=> 1.18,2 = nY.26 => nY = 0,7 mol
Phương trình phản ứng: CnH2n + H2 → N i , t 0 CnH2n+2
Ta có: nX = 1 mol; nY = 0,7 mol
=> Số mol H2 pứ = số mol CnH2n = 1- 0,7 = 0,3 mol
=> số mol H2 ban đầu = 0,3 + 0,4 = 0,7 mol
Ta có: M _ X = 0,7.2 + 0,3.14n = 18,2 => n = 4 => anken: C4H8
X + HBr cho 1 sản phẩm duy nhất => X là but-2-en

Đáp án A
Giả sử có 1 mol hỗn hợp X gồm H2 và anken ![]()
Ta có:
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
![]()
Phương trình phản ứng:
![]()
Ta có: nX = 1 mol; nY = 0,7 mol
![]()
![]()
Ta có: anken đó là C4H8
X phản ứng với HBr cho 1 sản phẩm duy nhất nên X là But-2-en
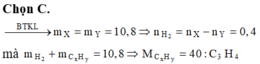
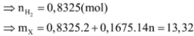

Đáp án D
hhX gồm H2 và CnH2n có d/H2 = 6.
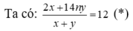
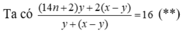
Nung X với Ni → hhY không làm mất màu dd brom và có d/H2 = 8.
• Đặt nH2 = x mol; nCnH2n = y mol.
• hhY gồm ankan CnH2n + 2 y mol và H2 dư (x - y) mol.
Từ (*), (**) → x = 3y → n = 3 → C3H6