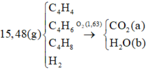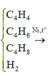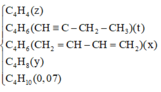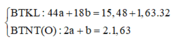Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$n_{C_2H_2} = n_{Ag_2C_2} = \dfrac{24}{240} = 0,1(mol)$
$\Rightarrow n_A = n_X - n_{C_2H_2} = 0,2(mol)$
Ta có :
$0,1.26 + 0,2.A = 13,8 \Rightarrow A = 56(C_4H_8)$
Vậy A là $C_4H_8$
CTCT :
$CH_2=CH-CH_2-CH_3$ : But-1-en
$CH_3-CH=CH-CH_3$ : But-2-en
$CH_2=C(CH_3)-CH_3$ : 2-metyl propen
b)
PTHH : $CH_3-CH=CH-CH_3 + H_2O \xrightarrow{t^o,H^+} CH_3-CH_2-CH(OH)-CH_3$
c) Sai đề

Đáp án D
Giả sử có 1 mol hỗn hợp F
![]()
Ta có:
![]()
![]()
→ M a n k i n < 38 , 32
Do vậy thỏa mãn ankin là C2H2.
Cho 0,75 mol F (15,12 gam) dẫn qua bình 1 đựng AgNO3/NH3 chỉ có ankin dư phản ứng. Sản phẩm còn lại dẫn qua bình 2 thấy tăng 8,4 gam do C2H4 phản ứng
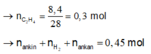
Mà ta có:
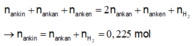
Vậy kết tủa thu được là Ag2C2 0,225 => m = 54 gam

Đáp án D
Giả sử có 1 mol hỗn hợp F
![]()
Ta có:
![]()
![]()
→ M a n k i n < 38 , 32
Do vậy thỏa mãn ankin là C2H2.
Cho 0,75 mol F (15,12 gam) dẫn qua bình 1 đựng AgNO3/NH3 chỉ có ankin dư phản ứng. Sản phẩm còn lại dẫn qua bình 2 thấy tăng 8,4 gam do C2H4 phản ứng
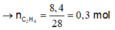
![]()
Mà ta có:
![]()
![]()
Vậy kết tủa thu được là Ag2C2 0,225 => m = 54 gam

Đáp án D
Đặt a, b, c lần lượt là số mol CH4, C2H4, C2H2 (trong 8,6 gam X)
Ta có: 16a + 28b + 26c = 8,6 (1)
b + 2c = 0,3 (2)
Mặt khác: Gọi số mol của CH4, C2H4, C2H2 trong 13,44 lít hỗn hợp X lần lượt là kx, ky, kz
![]() (3)
(3)
![]()
kc kc
Ta có
nkết tủa ![]() (4)
(4)
Lấy (3) chia (4) được
![]() (5)
(5)
Từ (1), (2) và (5) được

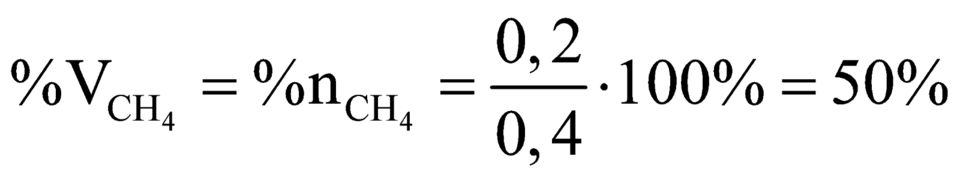

Đáp án A
Hướng dẫn
n B r 2 = 2 n X => nX = 0,05 mol => MX = 2 0 , 04 = 40 => CTPTX: C3H4
n C a C O 3 = n C O 2 = 0,05.3 = 0,15 (mol) → m↓ = 0,15.100 = 15 gam

Đáp án C
Gọi số mol CH4, C2H4, C2H2 lần lượt là a, b, c
=> 16a + 28b + 26c = 8,6
Cho 8,6 gam X tác dụng vừa đủ với 0,3 mol Br2 => b + 2c = 0,3
Mặt khác 0,6 mol X tác dụng với AgNO3/NH3 thu được 36 gam kết tủa AgC≡CAg
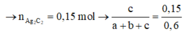
Giải hệ: a=0,2; b=0,1;c=0,1 nên %V CH4 =50%.

Đáp án C
Gọi số mol CH4, C2H4, C2H2 lần lượt là a, b, c => 16a + 28b + 26c = 8,6
Cho 8,6 gam X tác dụng vừa đủ với 0,3 mol Br2 => b + 2c = 0,3
Mặt khác 0,6 mol X tác dụng với AgNO3/NH3 thu được 36 gam kết tủa AgC≡CAg
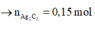
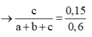
Giải hệ: a=0,2; b=0,1;c=0,1 nên %V CH4 =50%.