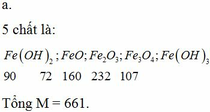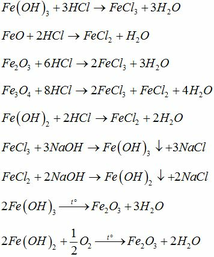Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có :
\(\text{nFeCL3=0.12 nAl2(SO4)3=0.08 nH2SO4=0.2}\)
a. nNaOH=1.94
\(\text{2NaOH+H2SO4-->Na2SO4+2H2O}\)
0.4................0.2..........................................(mol)
\(\text{nNaOH còn=1.54}\)
\(\text{FeCL3+ 3NaOH-->Fe(OH)+3NaCl}\)
0.12...............0.36............0.12..........................(mol)
\(\text{nNaOH còn =1.18}\)
\(\text{ Al2(SO4)3+ 6NaOH-->2Al(OH3)+3Na2SO4}\)
0.08.....................0.48............0.16.................................(mol)
\(\text{-->nNaOH còn=0.7}\)
\(\text{Al(OH)3+ NaOH-->NaAlO2+2H2O}\)
0.16.................0.16............0.16.......................................(mol)
nNaOh còn =0.54
Nung B 2Fe(OH)3-->Fe2O3+3H2O
0.12 0.06
m=9.6
b.mdd H2SO4 ban đầu =1.14*200=228g
-->MddC=19.5+27.36+228-0.12*107=262.02
m nước cần thêm là 400-mddC=137.98
\(\left\{{}\begin{matrix}\text{c%NaOH dư=0.54*40/400=0.054%}\\\text{c%NaAlO2=0.16*82/400=0.0328%}\end{matrix}\right.\)

\(\text{+ nFeCl3= }\frac{19,5}{162,5}=\text{ 0.12 mol}\)
\(\text{+ nAl2(SO4)3= }\frac{27,36}{342}\text{= 0.08 mol}\)
\(\text{+ nH2SO4= }\frac{200}{98}\text{x9.8%= 0.2 mol}\)
\(\text{+ nNaOH=}\frac{77,6}{40}\text{=1.94 mol}\)
+ Cho A + NaOH ta có:
+ Kết tủa B gồm: Fe(OH)3
+ Dd C gồm: NaOH dư ; Na2SO4 ; NaCl ; NaAlO2
\(\text{a) + Chất rắn D là : Fe2O3 0.06 mol}\)
\(\Rightarrow\text{mD= 160x 0.06=9.6 g }\)
b) + mdd C= 400g
\(\text{+ C% NaOH=}\text{5.4%}\)
\(\text{+ C% Na2SO4=}15,62\%\)
\(\text{+ C% NaCl=}5,625\%\)
\(\text{+ C% NaAlO2= }3,28\%\)
nFeCl3 = 0,12
nAl2(SO4)3 = 0,08
nH2SO4 = 0,2
nNaOH = 1,94
Ưu tiên phản ứng trung hòa trước: H2SO4 + 2NaOH —> Na2SO4 + 2H2O
0,2 ——-> 0,4
FeCl3 + 3NaOH —> Fe(OH)3 + 3NaCl
0,12 —-> 0,36
Al2(SO4)3 + 6NaOH —> 2Al(OH)3 + 3Na2SO4
0,08 ———-> 0,48
Sau 3 phản ứng thì còn lại nNaOH = 0,7, sau đó:
Al(OH)3 + NaOH —> NaAlO2 + 2H2O
0,16 ——-> 0,16
Nung kết tủa: 2Fe(OH)3 —> Fe2O3 + 3H2O
0,12 ————>0,06
m = 9,6 gam
Phần dung dịch chứa Na2SO4 (0,44 mol), NaCl (0,36 mol), NaAlO2 (0,16 mol) và NaOH dư (0,54 mol) —> C% ll là 15,62%; 5,625 %; 3,28%; 5,4%.

a)
$Fe_2(SO_4)_3 + 6KOH \to 2Fe(OH)_3 + 3K_2SO_4$
b)
$n_{Fe_2(SO_4)_3} = 0,3.1 = 0,3(mol)$
$n_{KOH} = \dfrac{16,8}{56} =0,3(mol)$
Ta thấy :
$n_{KOH} : 3 < n_{Fe_2(SO_4)_3} : 1$ nên $Fe_2(SO_4)_3$ dư
$n_{Fe(OH)_3} = \dfrac{1}{3}n_{KOH} = 0,1(mol)$
$n_{Fe_2O_3} = \dfrac{1}{2}n_{Fe(OH)_3} = 0,05(mol)$
$m_{Fe_2O_3} = 0,05.160 = 8(gam)$

- voquangnhan1311

Đáp án:
Giải thích các bước giải:
Gọi x, y, z tương ứng là số mol của Mg, Al, Fe có trong 14,7 g hỗn hợp A:
- Hoà tan trong NaOH dư:
Al + NaOH + H2O NaAlO2 + 1,5H2
y 1,5y/mol
1,5y = 3,36/22,4 = 0,15 à y = 0,1
- Hòa tan trong HCl dư:
Mg + 2HCl MgCl2 + H2
x x/mol
Al + 3HCl AlCl3 + 1,5H2
y 1,5y/mol
Fe + 2HCl FeCl2 + H2
z z/mol
Theo đề và trên, ta có:
24x + 27y + 56z = 14,7 (1)
x + 1,5y + z = 10,08/22,4 = 0,45 (2)
y = 0,1 (3)
Giải hệ (1, 2, 3), ta được: x = z = 0,15; y = 0,1.
Vậy % về khối lượng:
m (Mg) = 24.0,15 = 3,6 (g) chiếm 24,49%
m (Al) = 27.0,10 = 2,7 (g) chiếm 18,37%
m (Fe) = 56.0,15 = 8,4 (g) chiếm 57,14%.
- Cho ddB + NaOH dư, nung kết tủa trong không khí thu được rắn gồm (MgO, Fe2O3)
m = 18 gam.

a) Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓ (1)
2Fe(OH)3 \(\underrightarrow{to}\) Fe2O3 + 3H2O (2)
\(m_{Fe_2\left(SO_4\right)_3}=200\times16\%=32\left(g\right)\)
\(\Rightarrow n_{Fe_2\left(SO_4\right)_3}=\frac{32}{400}=0,08\left(mol\right)\)
\(n_{NaOH}=0,3\times2=0,6\left(mol\right)\)
Theo Pt1: \(n_{Fe_2\left(SO_4\right)_3}=\frac{1}{6}n_{NaOH}\)
Theo bài: \(n_{Fe_2\left(SO_4\right)_3}=\frac{2}{15}n_{NaOH}\)
Vì \(\frac{2}{15}< \frac{1}{6}\) ⇒ NaOH dư
Theo PT1: \(n_{Fe\left(OH\right)_3}=2n_{Fe_2\left(SO_4\right)_3}=2\times0,08=0,16\left(mol\right)\)
Theo Pt2: \(n_{Fe_2O_3}=\frac{1}{2}n_{Fe\left(OH\right)_3}=\frac{1}{2}\times0,16=0,08\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,08\times160=12,8\left(g\right)\)
Vậy \(a=12,8\left(g\right)\)
b) \(m_{ddNaOH}=300\times1,02=306\left(g\right)\)
\(m_{Fe\left(OH\right)_3}=0,16\times107=17,12\left(g\right)\)
Ta có: \(m_{dd}saupư=200+306-17,12=488,88\left(g\right)\)
Theo pT1: \(n_{NaOH}pư=6n_{Fe_2\left(SO_4\right)_3}=6\times0,08=0,48\left(mol\right)\)
\(\Rightarrow n_{NaOH}dư=0,6-0,48=0,12\left(mol\right)\)
\(\Rightarrow m_{NaOH}dư=0,12\times40=4,8\left(g\right)\)
\(\Rightarrow C\%_{NaOH}dư=\frac{4,8}{488,88}\times100\%=0,98\%\)
Theo PT1: \(n_{Na_2SO_4}=3n_{Fe_2\left(SO_4\right)_3}=3\times0,08=0,24\left(mol\right)\)
\(\Rightarrow m_{Na_2SO_4}=0,24\times142=34,08\left(g\right)\)
\(\Rightarrow C\%_{Na_2SO_4}=\frac{34,08}{488,88}\times100\%=6,97\%\)