Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Áp dụng phương pháp đường chéo cho hỗn hợp X:
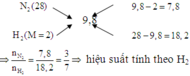
Cách 1: Gọi số mol N2 là 3x thì số mol H2 là 7x ⇒ tổng số mol hỗn hợp X là 3x + 7x = 10x
Thay vào công thức:
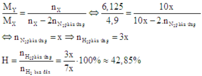
Cách 2: Áp dụng công thức tính nhanh với trường hợp x < 3y:
Hiệu suất phản ứng:
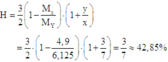

Đáp án A

Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9.
→Khối lượng mol của hỗn hợp khí sau phản ứng là 8,5 : 0,9=85/9 (g/mol)


PT: \(N_2+3H_2\underrightarrow{t^o}2NH_3\)
VN2 : VH2 = 1:3
VN2 + VH2 = 10
⇒ VN2 = 2,5 m3, VH2 = 7,5 m3
Ở cùng điều kiện nhiệt độ áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
Theo PT: \(V_{NH_3\left(LT\right)}=2V_{H_2}=5\left(m^3\right)\)
Mà: H = 95% ⇒ VNH3 (TT) = 5.95% = 4,75 (m3)

Gọi hh khí ban đầu là X và hh khí sản phẩm là Y.
\(d_{\dfrac{X}{H_2}}=3,6\rightarrow M_X=3,6.2=7,2\left(\dfrac{g}{mol}\right)\)
Ta có:
\(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{7,2-2}{28-7,2}=\dfrac{5,2}{20,8}=\dfrac{1}{4}\) ( quy tắc đường chéo )
Gọi x là số mol N2 tham gia phản ứng.
PTHH:
\(N_2+3H_2\xrightarrow[Fe]{t^o}2NH_3\)
Trc p/ư: 1 4
p/ư: x 3x 2x (mol)
sau p/ư: 1-x 4-3x 2x
\(\rightarrow n_Y=1-x+4-3x+2x=5-2x\left(mol\right)\)
\(d_{\dfrac{Y}{H_2}}=4,5\rightarrow M_Y=4,5.2=9\left(\dfrac{g}{mol}\right)\)
BTKL: mX = mY
\(m_Y=1.28+4.2=36\left(g\right)\)
\(\rightarrow\dfrac{36}{9}=5-2x\)
\(\rightarrow x=0,5\)
Giả sử phản ứng xảy ra hoàn toàn:
\(\dfrac{1}{1}< \dfrac{4}{3}\) --> N2 hết, H2 dư.
Trước:
\(\%V_{N_2}=\dfrac{1.22,4}{5.22,4}.100\%=20\%\)
\(\%V_{H_2}=100\%-20\%=80\%\)
Sau:
\(\%V_{NH_3}=\dfrac{1.22,4}{4.22,4}.100\%=25\%\)
\(\%V_{N_2}=\dfrac{\left(1-0,5\right).22,4}{4.22,4}.100\%=12,5\left(\%\right)\)
\(\%V_{H_2}=\dfrac{\left(4-1,5\right).22,4}{4.22,4}.100\%=62,5\%\)

Đáp án B
Hỗn hợp ban đầu chứa N 2 : 0 , 2 H 2 : 0 , 8
→ Hiệu suất tính theo N2.
nsau = 3,6/4 = 0,9 → N2 phản ứng = 0,05 → H = 25%