Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử số mol hỗn hợp ban đầu là 1 mol
--> nA=0,9(mol) , nO2=0,1(mol)
pt CnH2n+2 + (3n+1)/2 O2 ---> nCO2 + (n+1)H2O (*)
Từ (*) => nA phản ứng là 0,2/(3n+1) mol, nCO2 = 0,2n/(3n+1) mol
Số mol hh sau phản ứng là 0,9 - 0,2/(3n+1) + 0,2n/(3n+1) mol
Áp dụng pt trạng thái Vp=nRT ta có
n hh ban dau/ n hh sau phản ứng = p1/p2 = 2/1,4
tức là 1/(0,9 - 0,2/(3n+1) + 0,2n/(3n+1)) = 2/1,4
biến đổi đại số tìm được n.
Nếu ko tìm được n thì đề bài có vấn đề.
Mình tìm ra n = 0, nếu sửa đề bài là áp suất bình sau phản ứng là 1,8 atm thì kết quả là CH4

Đáp án D
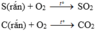
Từ 2 phương trình trên ta thấy số mol khí của chất tham gia phản ứng và sau phản ứng bằng nhau và không phụ thuộc vào lượng C, S => do vậy áp suất của bình sẽ không thay đổi khi ta đưa về nhiệt độ ban đầu

1. Giả sử hỗn hợp A có X mol C n H 2 n + 2 và y mol C m H 2 m + 2 :
(14n + 2)x + (14m + 2)y = 1,36 ⇒ 14(nx + my) + 2(x + y) = 1,36 (1)
Khi đốt hỗn hợp A:
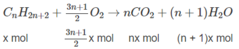
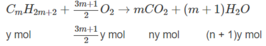
n C O 2 = n C a C O 3 = 0,09(mol)
⇒ nx + my = 0,09 (2)
Từ (1) và (2), tìm được x + y = 0,05.
Số mol O 2 trước phản ứng: n O 2 = 0,2(mol).
Tổng số mol khi trước phản ứng: 0,2 + 0,05 = 0,25 (mol).
Nếu ở đktc thì V O = 0,25.22,4 = 5,6 (lít).
Thực tế V 1 = 11,2 (lít)
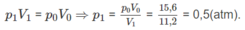
Số mol hơi nước: (n + 1)x + (m + 1)y = nx + my + x + y = 0,14
Số mol O 2 dự phản ứng:
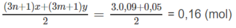
Số mol O 2 còn dư: 0,2 - 0,16 = 0,04 (mol).
Tổng số mol khí sau phản ứng: 0,09 + 0,14 + 0,04 = 0,27 (mol).
Nếu ở đktc thì V ' O = 0,27.22,4 = 6,048 (lít)
Thực tế V 2 = 11,20 (lít)
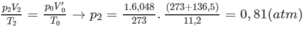
2) Nếu n < m thì x = 1,5y;
Vậy x = 0,03; y = 0,02
0,03n + 0,02m = 0,09 ⇒ 3n + 2m = 9
3n = 9 - 2m 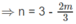
n và m nguyên dương nên m = 3 và n = 1.
C H 4 chiếm 60% thể tích hỗn hợp.
C 3 H 8 chiếm 40% thể tích hỗn hợp.

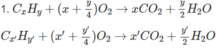
H 2 S O 4 + n H 2 O → H 2 S O 4 .n H 2 O
2NaOH + C O 2 → N a 2 C O 3 + H 2 O
Số mol
C
O
2
là: 
Khối lượng C trong hỗn hợp A là: 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là: 1,3 - 1,14 = 0,16 (g).
Số mol
H
2
O
sau phản ứng là: 
Để tạo ra 0,095 mol C O 2 cần 0,095 mol O 2 ;
Để tạo ra 0,08 mol H 2 O cần 0,04 (mol) O 2 .
Số mol O 2 đã tham gia phản ứng là: 0,095 + 0,04 = 0,135 (mol).
Số mol
O
2
ban đầu là: 
Số mol O 2 còn dư là: 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng:
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì V O = 0,195.22,4 = 4,37 (lít).
Thực tế V2 = 8,4 lít
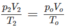
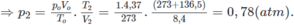
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc:
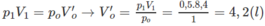
Số mol khí trước phản ứng: 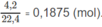
Số mol 2 hiđrocacbon: 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng C n H 2 n là a mol, lượng C m H 2 m - 2 là b mol, ta có a + b = 0,0325.
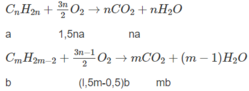
Số mol O 2 : l,5na + (l,5m - 0,5)b = 0,135 (2)
Số mol C O 2 : na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 ⇒ a = 0,0175
Thay các giá trị của a và b vào (3), ta có :
1,75. 10 - 2 n + 1,5. 10 - 2 m = 9,5. 10 - 2
7n + 6m = 38
Nếu n = 2 thì 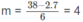
Nếu n = 3 thì 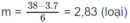
Nếu n > 3 thì m < 2 (loại).
% về thể tích của
C
2
H
4
: 
% về thể tích của C 4 H 6 là 46,2%

Thử làm câu 1, câu 2 tương tự:
\(C_xH_y+\left(x+\frac{y}{4}\right)O_2\rightarrow xCO_2+\frac{y}{2}H_2O\)
\(pV=RnT\Rightarrow n_{hh}=\frac{pV}{RT}=\frac{1.0,5}{0,082.\left(273+135,5\right)}\approx0,015\left(mol\right)\)
Do khi hạ nhiệt độ xuống bằng nhiệt độ ban đầu, áp suất hỗn hợp sau khi đốt bằng áp suất ban đầu nên số mol cũng bằng số mol ban đầu hay:
\(1+x+\frac{y}{4}=x+\frac{y}{2}\Rightarrow y=4\)
Gọi số mol \(C_xH_4\) ban đầu là \(a\Rightarrow n_{O_2}=2a\left(x+1\right)\); \(n_{CO2}=a.x\)
Ta có: \(a+2a\left(x+1\right)=0,015\)
Khi hạ nhiệt xuống \(0^0C\) thì phần hơi nước ngưng tụ và đóng băng, áp suất khí trong bình chỉ còn do \(CO_2\) và \(O_2\) dư gây ra
Khí trong bình khi đó còn \(a\left(x+1\right)\) mol \(O_2\) dư và \(ax\) mol \(CO_2\) \(\Rightarrow\) tổng số mol khí là \(2ax+a\)
Áp dụng pt trạng thái khí:
\(pV=RnT\Rightarrow0,52.0,5=0,082.\left(2ax+a\right).273\)
\(\Rightarrow2ax+a=\frac{10}{861}\)
\(\Rightarrow\left\{{}\begin{matrix}2ax+3a=0,015\\2ax+a=\frac{10}{861}\end{matrix}\right.\) \(\Rightarrow x=3\)
Vậy hidrocacbon là \(C_3H_4\)
Ủa sai ở đâu mà ko giống đáp án vậy ta :(
Mọi người giúp với ạ