Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Giả sử trộn 1 mol X và 15 mol Y → số mol O2 : 3 mol, số mol N2 : 12 mol
Gọi số mol của CO2 và H2O lần lượt 7x và 4x mol
Bảo toàn nguyên tố O → 7x. 2 + 4x = 3.2 → x = 1/3 mol
Vậy sau phản ứng trong bình chứa 7/3mol CO2 , 4/3 mol H2O và 12 mol N2
Có trong cùng điều kiện nhiệt độ thể tích thì


Đáp án B
Có ![]()
Gọi công thức hidrocacbon A là ![]() và nA = a.
và nA = a.
Có phản ứng:
![]()
a ka a
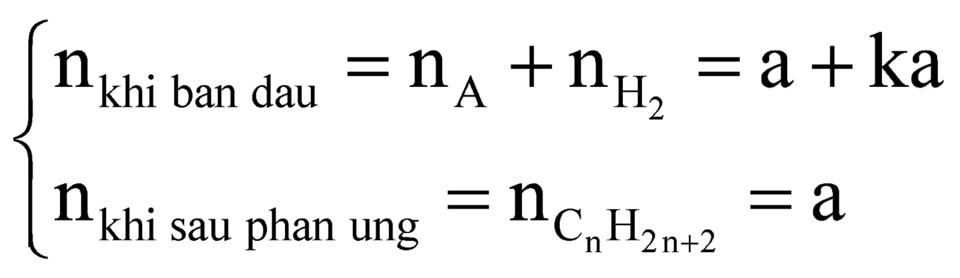
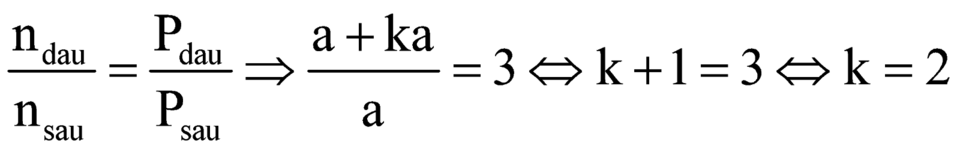
Mặt khác:
![]()
![]() .
.
Vậy A là C2H2.

H 2 S O 4 + n H 2 O → H 2 S O 4 .n H 2 O
2NaOH + C O 2 → N a 2 C O 3 + H 2 O
Số mol
C
O
2
là: 
Khối lượng C trong hỗn hợp A là: 0,095.12 = 1,14 (g).
Khối lượng H trong hỗn hợp A là: 1,3 - 1,14 = 0,16 (g).
Số mol
H
2
O
sau phản ứng là: 
Để tạo ra 0,095 mol C O 2 cần 0,095 mol O 2 ;
Để tạo ra 0,08 mol H 2 O cần 0,04 (mol) O 2 .
Số mol O 2 đã tham gia phản ứng là: 0,095 + 0,04 = 0,135 (mol).
Số mol
O
2
ban đầu là: 
Số mol O 2 còn dư là: 0,155 - 0,135 = 0,02 (mol).
Số mol 3 chất trong bình sau phản ứng:
0,095 + 0,08 + 0,02 = 0,195 (mol).
Nếu ở đktc thì V O = 0,195.22,4 = 4,37 (lít).
Thực tế V2 = 8,4 lít
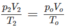
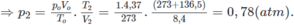
2. Đổi thể tích hỗn hợp khí trước phản ứng về đktc:
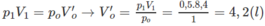
Số mol khí trước phản ứng: 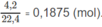
Số mol 2 hiđrocacbon: 0,1875 - 0,155 = 0,0325 (mol).
Đặt lượng C n H 2 n là a mol, lượng C m H 2 m - 2 là b mol, ta có a + b = 0,0325.
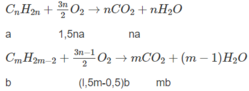
Số mol O 2 : l,5na + (l,5m - 0,5)b = 0,135 (2)
Số mol C O 2 : na + mb = 0,095 (3)
Từ (2) và (3), tìm được b = 0,015 ⇒ a = 0,0175
Thay các giá trị của a và b vào (3), ta có :
1,75. 10 - 2 n + 1,5. 10 - 2 m = 9,5. 10 - 2
7n + 6m = 38
Nếu n = 2 thì 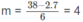
Nếu n = 3 thì 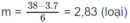
Nếu n > 3 thì m < 2 (loại).
% về thể tích của
C
2
H
4
: 
% về thể tích của C 4 H 6 là 46,2%

Có sự thay đổi số mol hỗn hợp khí xảy ra trong các phản ứng đốt cháy, hoặc đôi khi không thay đổi.
C/S + O2 → CO2/ SO2 (1)
2Al +3/2O2 → Al2O3 (2)
C, S hay A1, chúng là các chất rắn được đem đốt cháy với oxi hoặc một hỗn hợp khí chứa oxi,… và sau phản ứng người ta thu được một khí/hỗn hợp khí mới,…
Trong nhiều trường hợp, ta cần so sánh số mol hỗn hợp khí mới và cũ, như trong tình huống (1), hai giá trị này bằng nhau, tình huống (2) thì khác, khi có oxit tạo thành, tổng số mol khí sẽ giảm.
Với bài tập này, phản ứng của cacbon với oxi xảy ra và số mol hỗn hợp khí không thay đổi, đó chỉ là một sự thay thế như tăng giảm khối lượng vậy, O2 trở thành CO2 theo tỉ lệ 1:1 → nZ = nT
Bảo toàn nguyên tố C: nC/T = nCO2/T = 0,528/12 =0,044
→nT = 0,044/22,92% = 0,192 = nZ → nO2 trộn = 0,192/4 =0,048
→m = mY + mO2 = 0,894/8,132% + 32.0,048 = 12,5296
Chọn đáp án C

Đáp án D
Từ 2 phương trình trên ta thấy số mol khí của chất tham gia phản ứng và sau phản ứng bằng nhau và không phụ thuộc vào lượng C, S => do vậy áp suất của bình sẽ không thay đổi khi ta đưa về nhiệt độ ban đầu