Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nHNO3=0.08(mol)
Do sau phản ứng,dd làm quỳ hóa đỏ->axit dư
mCa(OH)2=0.74(g)
nCa(OH)2=0.01(mol)
PTHH:A2O3+6HNO3->2A(NO3)3+3H2O(1)
2HNO3+Ca(OH)2->Ca(NO3)2+2H2O(2)
Theo pthh nCa(NO3)2=nCa(OH)2->nCa(NO3)2=0.01(mol)
mCa(NO3)2=1.64(g)
mA(NO3)3=6.48-1.64=4.84(g)
nHNO3(2)=2 nCa(OH)2->nHNO3(2)=0.02(mol)
nHNO3(1)=0.06(mol)
theo pthh nA(NO3)3=1/3 nHNO3->nA(NO3)3=0.02(mol)
MA(NO3)3=4.84:0.02=242
->MA=242-14*3-16*9=56(g/mol)
->Kim loại A là Fe

Gọi công thức oxit kim loại là M2O3:
nHNO3=0.2*0.4=0.08(mol)
m(Ca(OH)2)=50*1.48/100=0.74(g)
=>nCa(OH)2=0.74/74=0.01(mol)
PTHH: M2O3+6HNO3=>2M(NO3)3+3H2O
1/75 0.08 2/75
=>nM(NO3)3(đầu)=2/75(mol)
2M(NO3)3+3Ca(OH)2=>3Ca(NO3)3+2M(OH)3
1/150 0.01 0.01
nCa(NO3)2=0.01(mol)
nM(NO3)3(pư)=0.01*2/3=1/150(mol)
nM(NO3)3(dư)=2/75-1/150=0.02(mol)
Vậy sau phản ứng còn lại muối Ca(NO3)2 và M(NO3)3.
mCa(NO3)2=0.01*164=1.64(g)
mM(NO3)3=0.02*(M+186) m=mCa(NO3)2+mM(NO3)3=6.48
<=>0.02*(M+186)=4.84
<=>0.02M=1.12
<=>M=56
Vậy công thức oxit ban đầu là Fe2O3.
cChúc em học tốt!!
ak vì M hóa trị 3,oxi hóa trị 2 nên theo quy tắc hóa trị nên đặt CTHH là M2O3 đó em

Gọi CT của oxit : RO
n RO = a ( mol )
PTHH:
RO + H2SO4 ====> RSO4 + H2O
a--------a------------------a
theo pthh:
n H2SO4 = n RSO4 = n RO = a ( mol )
Có: n H2SO4=a ( mol ) => m H2SO4 = 98a ( g )
=> m dd H2SO4 20% = 490a ( g )
BTKL: m dd sau phản ứng = a ( R + 16 ) + 490a = aR + 506a ( g )
Lại có :
n RSO4 = a ( mol ) => m RSO4 = aR + 96a
=> \(\dfrac{aR+96a}{aR+506a}=\dfrac{22,64}{100}\Rightarrow\dfrac{a\left(R+96\right)}{a\left(R+506\right)}=\dfrac{22,64}{100}\)
\(\Rightarrow R=24\left(Mg\right)\)
Vậy CT: MgO

a) CTHH: R2O3
\(m_{H_2SO_4}=\dfrac{294.20}{100}=58,8\left(g\right)=>n_{H_2SO_4}=\dfrac{58,8}{98}=0,6\left(mol\right)\)
PTHH: R2O3 + 3H2SO4 --> R2(SO4)3 + 3H2O
_______0,2<------0,6---------->0,2_________________(mol)
=> \(M_{R_2O_3}=\dfrac{32}{0,2}=160\left(g/mol\right)=>M_R=56\left(Fe\right)\)
b) \(m_{Fe_2\left(SO_4\right)_3}=0,2.400=80\left(g\right)\)

Gọi CT oxit : \(R_2O_x\)
Ta có \(n_{R_2O_x}=\dfrac{3,2}{2R+16x}\left(mol\right)\)
PTHH: \(R_2O_x+xH_2SO_4\rightarrow R_2\left(SO_4\right)_x+xH_2O\) (1)
\(\dfrac{3,2}{2R+16x}\)---->\(\dfrac{3,2}{2R+16x}.x\)-->\(\dfrac{3,2}{2R+16x}\) (mol)
\(H_2SO_{4\left(dư\right)}+CaCO_3\rightarrow CaSO_4+CO_2+H_2O\) (2)
\(n_{CO_2}=\dfrac{0,244}{22,4}=0,01\left(mol\right)\)
Theo PT (2) : \(n_{CO_2}=n_{CaSO_4}=n_{H_2SO_4dư}=0,01\left(mol\right)\)
Ta có : \(m_{muối}=\text{}\dfrac{3,2}{2R+16x}.\left(2R+96x\right)+0,01.136=9,36\left(g\right)\)
\(\dfrac{3,2}{2R+16x}\).(2R+96x)=8
Lập bảng :
| x | 1 | 2 | 3 |
| R | 18,67 | 37,33 | 56 |
| Kết luận | Loại | Loại | Chọn (Fe) |
=> Oxit là Fe2O3
\(\Sigma n_{H_2SO_4}=0,02.3+0,01=0,07\left(mol\right)\)
=> \(C\%_{H_2SO_4}=\dfrac{0,07.98}{200}.100=3,43\%\)

CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
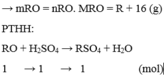
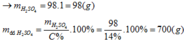
![]()
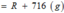
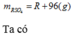

Vậy công thức của oxit kim loại là MgO

Gọi CTHH oxit kim loại là \(RO\)
Giả sử có 1mol oxit pứ
\(RO+H_2SO_4\rightarrow RSO_4+H_2O\)
\(1-\rightarrow1---\rightarrow1\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{4,9}\cdot100=2000\left(g\right)\\ m_{ddRSO_4}=1\left(R+16\right)+2000=2016+R\left(g\right)\\ C_{\%RSO_4}=\dfrac{1\left(R+96\right)}{2016+R}\cdot100=5,88\%\\ \Rightarrow R\approx24\left(g/mol\right)\)
Vậy R là Mg
50 g dung dịch phải không bạn
mình cũng không rõ nữa thầy chỉ ra đề vậy thôi